Володина В. В., Баринова В. В., Менькова А. В., Сакетова К. Ш., Гнучева В. И., Яковлева Е. П., Лушникова А. А.
ФГБНУ «Каспийский научно-исследовательский институт рыбного хозяйства», г. Астрахань Адрес: 414056, Россия, Астрахань, ул. Савушкина, 1 FSBSI Caspian Fisheries Research Institute, Astrakhan Address: 414056, Russia, Astrakhan, Savushkina Sir., 1
Введение
Благополучие объектов аквакультуры по инвазионным и инфекционным заболеваниям - важнейшее условие, необходимое для нормального функционирования и рентабельности рыбоводного хозяйства. Повышение интенсификации рыбоводного процесса, как правило, приводит к ухудшению экологической и эпизоотической ситуации, а зачастую и к возникновению эпизоотии, что наносит прямой экономический ущерб от потерь, связанных как с гибелью рыб, так и с недополучением рыбного сырья высоко-го качества. В связи с этим для поддержания эпизоотического благополучия рыбоводных хозяйств необходимо не только регулярно проводить профилактические рыбоводно-мелиоративные мероприятия, но и иметь достаточное количество и широкий ассортимент лекарственных средств.
Основой государственного контроля качества и безопасности выпускаемых лекарственных препаратов в области ветеринарии служит лицензирование фармацевтической деятельности, осуществляемой согласно ФЗ «О лицензировании отдельных видов деятельности» от 04.05.2011 г. № 99-ФЗ, с изменениями и дополнениями от 03.08.2018 г. [16]; приказа Россельхознадзора от 19.04.2012 г. № 191 «О лицензировании фармацевтической деятельности», с изменениями и дополнениями от 18.05.2012 г. [10].
Следует отметить, что применение неза-регистрированных препаратов допускается только при проведении их производственных испытаний, при этом препарат должен пройти полный цикл доклинических исследований (определение токсичности для рыб и теплокровных животных, сроков выведения вещества из рыбы, влияние его на воспроиз-водительную функцию, потомство и т. д.).
Для профилактики инфекционных заболеваний рыб на рыбоводных хозяйствах в соответствии с документом «Рекомендации по организации противопаразитарных обработок в рыбоводстве» [12], утвержденным Департаментом ветеринарии Минсельхозпрода РФ 07.10.1999 г., эффективно использовали органический краситель «фиолетовый К», однако при вступлении в силу с 1 сентября 2017 года стандартов на рыбную продукцию в соответствии с требованиями технического регламента Евразийского экономического союза «О безопасности рыбы и рыбной продукции» (ТР ЕАЭС 040/2016) [15] применение данного химиотерапевтического средства запрещено. Запрет на использование красителей в аквакультуре обусловлен опасностью для здоровья человека от употребления рыбы, содержащий в себе данное средство: ряд исследований показал наличие у веществ явных канцерогенных и тератогенных свойств [11].
В связи с этим целью исследований является поиск эффективных противомикозных средств, допустимых к применению в аквакультуре.
Микозы у рыб и икры инициируют плесневые микромицеты порядка сапролегние-вые (Saprolegniales), относящиеся к несколь-ким родам: Achlya, Aphonomyces, Dictyuchus, Leptolegnia, Saprolegnia и др. [4]. По классификации Г. Ц. Айнсворта сапролегниевые грибы принадлежат к царству грибов, отделу Eumycota, классу Oomycetes, порядку Saprolegniales, семейству Saprolegniaceae. Наиболее распространенными и патогенными являются следующие виды: Ach. flagellate, Ach. laevis, D. monosporus, S. ferax, S. mixta, S. parasitica [5]. Температурный оптимум для вышеуказанных видов микроорганиз-мов составляет 15-20°С, как и для развития оплодотворенной икры осетровых рыб. Кроме того, при интенсивном выращивании рыб в системах замкнутого водоснабжения, в отличие от прямоточных систем, возрастает риск распространения инфекционного агента и повышения уровня зараженности рыб. Сапролегнией, как правило, поражается не-оплодотворенная, травмированная, физиологически неполноценная икра при инкубировании. При контакте с мертвой икрой, пораженной микромицетами, возможно заражение и живых развивающихся икринок. Потери от этого заболевания могут достигать 90 % [5, 6]. Негативное влияние представителей pp. Saprolegniales и Achlya выражено в разрыхлении поверхности оболочек икры с последующей их деструкцией и вакуолизацией, в ряде случаев гифы прорастают внутрь икринок.
Материалы и методы
Материалом для исследований послужила оплодотворенная икра стерляди {Acipenser ruthenus), пробы воды и налета с поверхности тела карповых рыб, зараженных сапролегнией, и пораженная микромицетами икра осетровых видов рыб (севрюги) в период инкубации. Эксперимент по искусственному воспроизведению сапролегниоза на икре осетровых рыб и апробации веществ в борьбе с микозной инфекцией проводили с февраля по июнь 2018 г. Обработку икры дезинфицирующими средствами проводили методом кратковременных лечебных ванн [2, 11] на 16-й и 21-й стадиях развития [5]. Для оценки воздействия дезинфицирующих средств на развитие эмбрионов определяли стандартные рыбоводно-биологические показатели: процент оплодотворения, развития, выкле-ва предличинок [13], а также процент заражения микромицетами p. Saprolegnia, процент патологий [1]. Показатели определяли с использованием микроскопа Биомед МС-1 Стерео. [4, 6, 7, 17]. При выделении и культивировании микромицетов, изолированных из пораженной икры, воды, использовали методы, применяемые для изучения водных оо-мицетов по Цейпу. Всего было собрано 330 проб и проведено 3630 анализов.
Работа с патогенными микроорганизмами проводилась в стерильных условиях на базе лаборатории ихтиопатологии ФГБНУ «Касп-НИРХ», имеющей лицензию на деятельность, связанную с паразитическими организмами, относящимися к III и IV группам патогенности. Производственную часть эксперимента осуществляли на базе НЭБ «Биос» ФГБНУ «КаспНИРХ». При планировании эксперимента были учтены обработки инкубаци-онных аппаратов, рыбоводного инвентаря хлорамином Б (20 г/м3 в течение 24 часов), регулярные заправки дезинфицирующих ковриков раствором «Forbicid» (0,5 %-ный раствор), а также соблюдение общих правил санитарии в инкубационном цехе.
Первый этап эксперимента включал в себя отработку методики выделения и культивирования «гросс-культуры» грибов р. Saprolegnia на различных приманках. Для этого были отобраны пробы воды и ватообразного налета с поверхности тела карпо-вых рыб, а также зараженная икра севрюги в период их инкубации на НЭБ «БИОС». В лабораторных условиях культивировали микромицеты с помощью «приманок» (проваренное льняное семя, личинки гаммаруса и вареный куриный белок) до образования зооспорангий и гемм. В дальнейшем эксперимент проводили с использованием культур, выделенных на вареном курином белке. «Приманку» с мицелием грибов промывали в стерильной водопроводной воде и помещали в стерильные чашки Петри с такой же водой. Инкубацию проводили при температуре 19-20°С. По мере роста мицелия проводили микроскопию для определения «чистоты» культуры и наличия органов размножения.
Помимо механического способа очистки культур от бактериального загрязнения при-меняли химические - в воду, содержащую мицелий грибов, добавляли растворы молочной и борной кислоты, задавая рН = 7-8.
На втором этапе эксперимента в лабораторных условиях в стерильные чашки Петри с оплодотворенной икрой (по 15 г) вносили стерильную водопроводную воду и «приманку», содержащую культуру грибов на стадии образования зооспор. В контрольные емкости вносили только икру. Опыты проведены при температуре воды 19-20°С, рН = 7-8, что максимально приближено к условиям инкубации на осетровых заводах.
Следующий этап эксперимента включал в себя апробирование химических веществ в производственных условиях. С этой целью для испытания были выбраны формалин, перекись водорода и «Монклавит-1», как средства, обладающие противомикробным, противовирусным и фунгицидным действием. В рыбоводной практике для предупреждения заражения сапролегниевыми грибами икру перед закладкой на инкубацию обрабатывают 0,5 % раствором формалина (экспозиция -3 мин). Ввиду того что формальдегид-токсичное вещество и под его воздействием происходит денатурация белка с образованием новых соединений, было решено использовать предельно низкие концентрации (табл. 1). Ветеринарный йодосодержащий препарат «Монклавит-1» был успешно апробирован на инкубируемой икре радужной форели [4], однако на данный момент отсутствует информация о его эффективности в борьбе с сапролегниозом у осетровых рыб. Перекись водорода разрушает токсины и уничтожает инфекционные агенты, является сильным окислителем и, согласно литературным источникам, может применяться в рыбоводстве [11]. Однако сведения о дозировках и схемах введения вещества отсутствуют.
Для эксперимента 07.06.2018 г. была получена икра (рис. За) от двух самок стерляди весом 3,6 кг и 2,8 кг и оплодотворена спермой от четырех самцов весом 1,8±0,05 кг. Оплодотворенную икру обесклеивали танином (0,7 г/л, экспозиция - 1 мин 40 сек) и закладывали в инкубационные аппараты типа «Осетр» (по 50 г на лоток) (рис 36). В эксперименте было задействовано 13 вкладышей (12 вкладышей на обработку испытуемыми растворами разных концентраций и 1 вкла-дыш - контроль). Стойка, задействованная в эксперименте, находилась в условиях прямотока. Ежедневно проводился гидрохими-ческий анализ воды [3].
В период инкубации провели экспериментальную обработку икры стерляди в ваннах с заданными концентрациями растворов формалина, перекиси водорода и препарата «Монклавит-1» (дважды - на 16 и 21 стадии развития икры), выдерживая икру в течение времени соответственно концентрациям растворов (Таблица 1). Перед обработкой испытуемыми веществами икру на 3-5 мин погружали в физиологический раствор в со-ответствии с технологией, принятой при работе с йодсодержащими препаратами в Финляндии [14]. Для выявления патомор-фологических изменений развивающихся эмбрионов перед ваннами и спустя час по-сле них проводили микроскопию из опыта и контроля.
Параллельно был проведен эксперимент по заражению оплодотворенной икры стер-ляди в чашках Петри в лабораторных усло-виях. В качестве «приманок» использовали вареное куриное яйцо и икру севрюги, по-раженную микромицетами p. Saprolegnia, предварительно промыв двукратно в сте-рильной водопроводной воде. Процесс за-ражения проходил при температуре воды 19-21°С,рН = 8-9.
Таблица 1
Дозировки испытуемых веществ при экспериментальной обработке оплодотворенной икры стерляди
|
Наименование |
Экспозиция, мин. |
Концентрация раствора, % |
|
Формалин |
3 |
0,0020 |
|
10 |
0,0010 |
|
|
15 |
0,0006 |
|
|
Перекись водорода |
5 |
0,0500 |
|
10 |
0,0300 |
|
|
15 |
0,0100 |
|
|
«Монклавит-1» |
10 |
3,0000 |
|
2,5000 |
||
|
2,0000 |
||
|
15 |
1,5000 |
|
|
1,0000 |
||
|
0,5000 |
В течение всего периода инкубации осуществляли контроль и фотофиксацию эмбрионального развития стерляди и определения процента развития икры после обработки, для этого в чашку Петри отбирали 200 икринок из каждого лотка и считали количество развивающихся и количество остановившихся в развитии.
Результаты исследований и обсуждение
При выполнении первого этапа эксперимента (выделение сапролегниевых микроми-цетов) активный рост грибов p. Saprolegnia отмечен на вареном курином белке, на семенах льна и личинках гаммаруса зарастание происходило слабо (рис. 1). Из двух выбранных кислот эффективной в борьбе с бактериальным загрязнением была борная кислота.
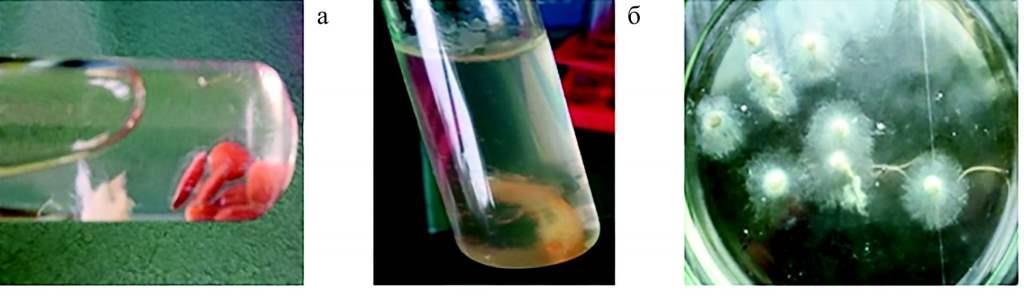
Рис. 1 Первый этап эксперимента. Виды «приманок»: проваренное льняное семя (рост грибов не отмечен) (а); личинка гаммаруса (рост грибов незначительный) (б); вареный куриный белок (отмечен активный рост грибов) (в)
В результате исследований из воды и из пораженной икры севрюги выделены гросскультуры грибов p. Saprolegnia.
Второй этап эксперимента заключался в отработке методики заражения оплодотворенной икры осетровых рыб паразитическими грибами/7. Saprolegnia. Для этой стадии опыта было проведено получение икры от двух самок стерляди, процент оплодотворения икры составил 90 % (согласно приказа № 377 Министерства сельского хозяйства РФ от 25.08.2015 г. средний процент оплодотворения - 60 %). Плодовитость соответствовала 84 шт./г (вес икры -11,9 мг)
Результаты показали, что заражение икры водными паразитическими грибами наступало через 12 часов (на 13-14 стадиях развития икры) (рис. 2). Через 30 часов после заражения на 20-21 стадии развития количество зараженной икры составило 5 %.

Рис. 2 Первый этап эксперимента: заражение оплодотворенной икры стерляди микромицетамиp.Saprolegnia («приманкой» служит зараженная икра белуги): икра стерляди через 12 часов после заражения (а); икра стерляди через 14 часов после заражения (б)
Третий этап эксперимента проводили в производственных условиях. Известно, что на развитие сапролегниоза влияет также качество икры, которое в первую очередь, связано с физиологическим состоянием производителей. Плодовитость в среднем соответствовала 68 икринок на грамм, процент оплодотворения - 85 %. Полученные показатели соответствовали норме [9] и являлись косвенным доказательством удовлетворительного состояния производителей стерляди в период нерестовой кампании.
Параллельно с производственным экспериментом проводили лабораторный по заражению икры сапролегниевыми микромицетами. Визуально начало заражения регистрировали через 11-13 часов после закладки икры (рис. 4). Патологии в пораженной сапролегниозом икре выражались в рыхлости верхней студенистой оболочки, разрушении желточных оболочек, сглаживании границ между ними, прорастании гифов внутрь оболочек. Через 35 часов от начала эксперимента процент поражения опытной икры составлял 7,3 % от общего числа, в результате микроскопирования зараженной икры было выявлено, что она остановилась в развитии. Спустя 7 часов уровень поражения достиг максимума, составив 10,6 % от общего числа икры.

Рис. 3. Второй этап эксперимента: получение икры от стерляди (а); инкубация оплодотворенной икры в инкубационных аппаратах типа «Осетр» (б)
Обработку оплодотворенной икры стерляди с зараженными «приманками» в чашках Петри проводили на 16 и 22 стадии по тем же схемам, как и обработку в аппарате. Результаты эксперимента показали, что микромицеты продолжали развиваться после обработок растворами как перекиси водорода, «Монклави-та-1», так и формалина, что указывает на низкую фунгицидную способность испытуемых веществ указанных концентраций.
Оплодотворенная икра, задействованная в эксперименте, при инкубации находилась в условиях прямотока. Гидрохимические показатели воды, приведенные в таблице 2, соответствовали нормативным [8], а также свидетельствовали об оптимальных ус-ловиях (t = 12,0-20,0°С; рН = 7,0-8,3; О2 = 8,0-14,5 мг/л) для развития микромицетов р. Saprolegnia [6].
По результатам третьего этапа - произ-водственного эксперимента, следует отме-тить, что среди выбранных концентраций раствора перекиси водорода при использо-вании 0,03 % выявлено наименьшее количе-ство икры, пораженной микромицетами, но, вместе с тем, имели место случаи развития повреждений в оболочках икры и остановки в их развитии (табл. 3).
Единственный эффективный 3%-ный раствор препарата «Монклавит-1», при использовании которого не регистрировался рост микромицетов, оказывал негативное влияние на оболочки икры, уплотняя их, что влияло на
Таблица 2 Гидрохимические показатели воды при инкубировании икры стерляди в эксперименте
|
Дата |
t°C |
рН |
О2 мг/л |
NH4 |
NO2 |
NO3 |
|
07.06.2018 |
18,4 |
7,6 |
6,4 |
0,66 |
0,12 |
4,7 |
|
08.06.2018 |
18,5 |
7,7 |
5,4 |
0,66 |
0,10 |
6,6 |
|
09.06.2018 |
18,9 |
7,6 |
6,7 |
0,56 |
0,09 |
6,4 |
|
13.06.2018 |
19,6 |
7,6 |
6,0 |
0,65 |
0,15 |
8,6 |
|
14.06.2018 |
19,7 |
7,8 |
7,8 |
0,43 |
0,14 |
5,5 |
|
15.06.2018 |
20,0 |
7,8 |
8,0 |
0,43 |
0,10 |
3,8 |
|
17.06.2018 |
20,4 |
7,9 |
8,0 |
0,16 |
0,07 |
3,7 |
выклев личинки. Так, при его использовании отмечено наименьшее количество выклюнувшейся личинки (1,8 %). Однако, именно эта концентрация препятствовала заражению здоровой икры от «приманки», и после двукратной обработки раствором этой концентрации процент зараженной икры микромицетами был наименьший (11 %) (табл. 4).
После обработки икры 0,002 % раствором формалина отмечен минимальный уровень микозного заражения, но максимальный показатель отхода (табл. 5). При этом количество развивающейся икры на стадии 23-24 в лотке с контрольной группой составил 76,9 %.
После первичной обработки (16 стадия) 1%-ным, 1,5%-ным и 2,5%-ным растворами препарата «Монклавит-1» зафиксировано увеличение случаев остановки эмбрионального развития (18 стадия) по сравнению с контрольной группой в среднем на 1,6 %.
При обработке икры остальными растворами препаратов процент остановившейся в развитии икры был меньше, чем в контрольной группе. После обработки растворами перекиси водорода и формалина (18-19 стадии) приблизительно у 5,3 % остановившейся в эмбриональном развитии икры отмечено нарушение структуры оболочки. Увеличение процента остановившейся в развитии икры наблюдалось после второй обработки на 22 стадии развития, особенно при обработке 0,002 % раствором формалина (9,3 %), 1,0 %, 3,0 % раствора «Монклавита-1» (21,4 %, 13,4 % соответственно), увеличение про-цента остановившейся в развитии икры при обработке перекисью водорода было прак-тически одинаковым для всех концентраций раствора (12,4-12,8 %). В контрольной группе, не подвергавшейся обработке, отмечено небольшое увеличение, от 18 к 23—24 стадии, «вставшей» икры, всего на 2,7 % (рис. 5). Со-
Таблица 3
Показатели выживаемости оплодотворенной икры в период инкубации после экспериментальной обработки растворами перекиси водорода
|
Концентрация вещества, % |
Стадия развития икры |
Количество икры, остановившейся в эмбриональном развитии, % |
Количество развивающейся икры, % |
Количество пораженной икры, % от общего количества в лотке |
|
0,01 |
18 |
13 |
87 |
18 |
|
23-24 |
25,8 |
74,2 |
30 |
|
|
0,03 |
18 |
15 |
85 |
3 |
|
23-24 |
27,4 |
72,6 |
7 |
|
|
0,05 |
18 |
15 |
85 |
14 |
|
23-24 |
27,3 |
72,7 |
30 |
|
|
Контрольная группа |
18 |
20,7 |
79,3 |
11 |
|
23-24 |
23,1 |
76,9 |
19 |
Таблица 4
Показатели выживаемости оплодотворенной икры в период инкубации после экспериментальной обработки препаратом «Монклавит-1»
|
Концентрация вещества, % |
Стадия развития икры |
Количество икры, остановившейся в эмбриональном развитии, % |
Количество развивающейся икры, % |
Количество пораженной икры, % от общего количества в лотке |
|
0,5 |
18 |
14,8 |
85,2 |
28 |
|
23-24 |
16,9 |
83,1 |
25 |
|
|
1 |
18 |
23,5 |
76,5 |
34 |
|
23-24 |
44,9 |
55,1 |
48 |
|
|
1,5 |
18 |
21,5 |
78,5 |
37 |
|
23-24 |
22,2 |
77,8 |
39 |
|
|
2 |
18 |
19,9 |
80,1 |
33 |
|
23-24 |
20,8 |
79,2 |
29 |
|
|
2,5 |
18 |
21,8 |
78,2 |
36 |
|
23-24 |
23,5 |
76,5 |
31 |
|
|
3 |
18 |
14,8 |
85,2 |
10 |
|
23-24 |
28,2 |
71,8 |
11 |
|
|
Контрольная группа |
18 |
20,7 |
79,3 |
11 |
|
23-24 |
23,1 |
76,9 |
19 |
гласно приказа № 377 Министерства сель-ского хозяйства РФ от 25.08.2015 г. процент выживаемости икры стерляди при инкубации равен 50 %.
Наибольший уровень патологий зарегистрирован на 23—24 стадии при использовании 0,002 % формалина и 0,03 % и 0,05 % перекиси водорода (рис. 6). Кроме уплотнения оболочки, патологических изменений в икре при обработке ее раствором «Монклавита-1» не зафиксировано.
В целом поражение микозной инфекцией икры осетровых рыб после двукратной обработки растворами разной концентрации (0,002%-ным формалином, 0,03%-ной перекисью водорода и 3,0 %-ным раствором препарата «Монклавит-1») снижалось на 12,0 %, 8,0 % и 9,0 % соответственно по сравнению с контрольной группой. Остальные концен-трации испытуемых веществ показали себя малоэффективными в борьбе с сапролегни-евыми грибами. Результаты эксперимента
Таблица 5
Показатели выживаемости оплодотворенной икры в период инкубации после экспериментальной обработки растворами формалина
|
Концентрация вещества, % |
Стадия развития икры |
Количество икры, остановившейся в эмбриональном развитии, % |
Количество развивающейся икры, % |
Количество пораженной икры, % от общего количества в лотке |
|
0,002 |
18 |
20,1 |
79,9 |
5 |
|
23-24 |
29,4 |
70,6 |
10 |
|
|
0,001 |
18 |
13,2 |
86,8 |
9 |
|
23-24 |
20,8 |
79,2 |
30 |
|
|
0,0006 |
18 |
11,3 |
88,7 |
11 |
|
23-24 |
20,2 |
79,8 |
40 |
|
|
Контрольная группа |
18 |
20,7 |
79,3 |
11 |
|
23-24 |
23,1 |
76,9 |
19 |
Таблица 6
Показатели выклева личинок стерляди при экспериментальной обработке икры растворами разной концентрации
|
Наименование |
Концентрация раствора, % |
Выклев личинки, % |
|
Формалин |
0,0020 |
10,0 |
|
0,0010 |
9,8 |
|
|
0,0006 |
16,0 |
|
|
Перекись водорода |
0,0500 |
3,4 |
|
0,0300 |
34,8 |
|
|
0,0100 |
40,7 |
|
|
«Монклавит-1» |
0,5 |
13,8 |
|
1 |
13,3 |
|
|
1,5 |
17,3 |
|
|
2 |
4,8 |
|
|
2,5 |
3,5 |
|
|
3 |
1,8 |
|
|
Контрольная группа |
0 |
87 |
свидетельствуют о том, что высокие концентрации апробируемых веществ являются эффективными в борьбе с микромицетами, но при этом отмечается негативное влияние таких концентраций на икру.
Минимальный показатель выклева отме-чен при использовании 3,0 %-ного раствора «Монклавита-1» (1,8 %). Максимальный выклев регистрировался при обработке икры 0,01%-ным раствором перекиси водорода (40,7 %) (табл. 6). В контроле процент выклева личинки составил 87,0 %.
Личинка при переводе из опытных лотков аппарата «Осетр» в пластиковые бассейны хорошо адаптировалась, сразу распределилась в толще воды, хорошо реагировала на тактильный и шумовой раздражители. При клиническом осмотре полученной личинки были выявлены следующие патологии:
- вздутие брюшка (у 2 % личинок, полученной от икры, обработанной 0,002 % раствором формалина);
- кровоизлияния в головном отделе (у 1 % личинок, полученной от икры, обработанной 0,05 % раствором перекиси водорода).
Таким образом, все концентрации раствора формалина способствовали уплотнению оболочки икры, что в дальнейшем препятствовало выходу личинок из оболочки. Через 6 дней наблюдали 100 % гибель личинки, выклюнувшейся от икры, обработанной формалином.
При использовании всех концентраций (Таб. 6) препарата «Монклавит-1» патологий у личинок не выявлено.
На фоне высокого процента выклева в контрольной группе выклев после обработки икры растворами испытуемых препара-тов выглядит неубедительным, и может сложиться впечатление, что обработка икры от микозной инфекции является нецелесообразной. Следует отметить, что инкубация икры проходила в системе с прямоточным водоснабжением. Данные условия, в сравнении с условиями замкнутого водоснабжения, препятствуют циркуляции микозной инфекции в системе. Обработка икры препаратами ведет к увеличению числа мертвой икры, которая является основным объектом заражения для грибов/?. Saprolegnia, а в контрольной группе это дополнительное условие отсутствовало. Нерестовая кампания на многих рыбоводных заводах начинается ранней весной, когда температура воды в реке составляет 5-6°С, поэтому процесс инкубации проводят в системах замкнутого водоснабжения с постоянной 16-18°С температурой, оптимальной для развития грибов p. Saprolegna, что будет спо-собствовать увеличению процента заражения икры микозной инфекцией.
Результаты эксперимента показали, что использование раствора формалина в любых концентрациях нецелесообразно, так как установлено, что личинка, выклюнувшаяся после обработки икры этим веществом, нежизнеспособна.
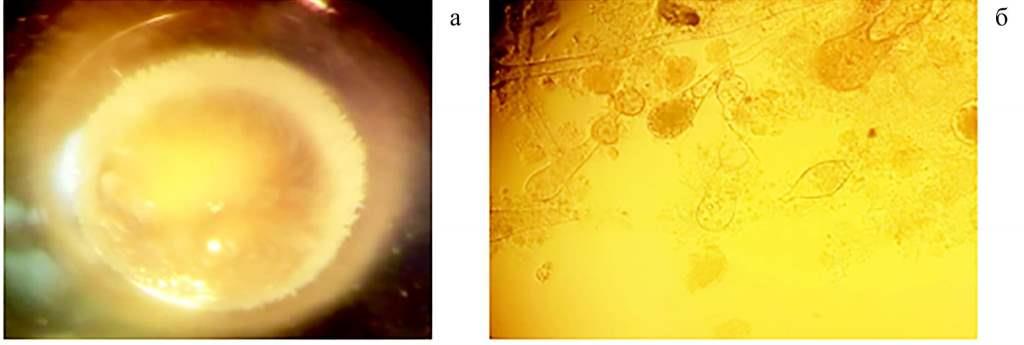
Рис. 4. Микромицеты Saprolegnia: поражение икры стерляди сапролегниозом (а); изолированная культура (б)
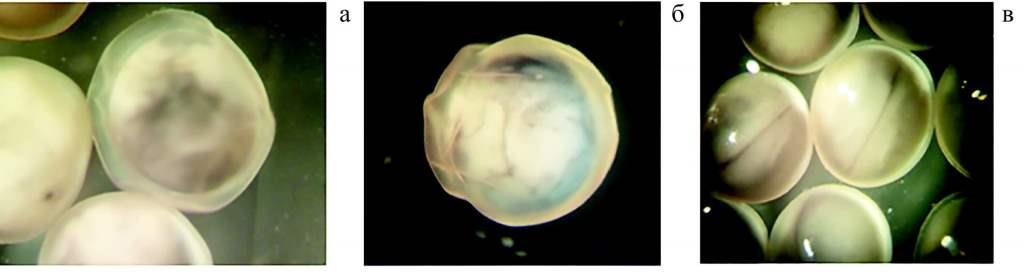
Рис. 5. Третий этап эксперимента. Внешний вид оплодотворенной икры стерляди: отслаивание поверхностного слоя после обработки перекисью водорода (23 стадия) (а); складчатая структура оболочки (22-23 стадия) (б); развитие икры без патологий (26 стадия) (в)
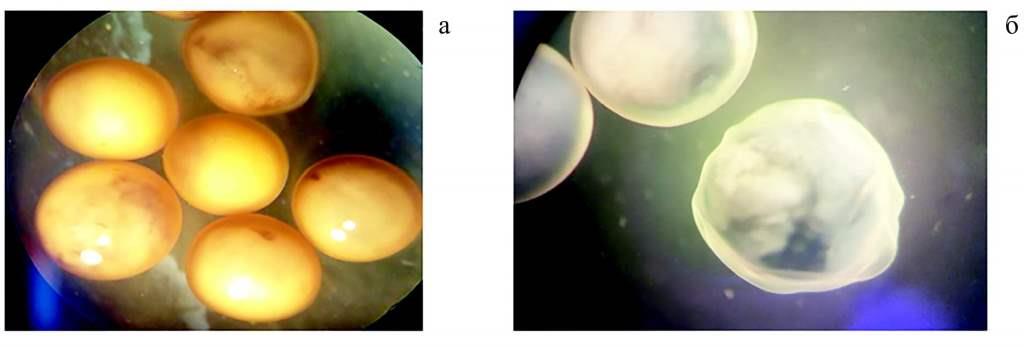
Рис. 6. Третий этап эксперимента. Внешний вид оплодотворенной икры стерляди после обработки растворами формалина: икра, остановившаяся в развитии (18 стадия) (а); складчатая структура оболочки (23 стадия) (б)
Апробация ветеринарного препарата «Монклавит-1» показала, что все испытуемые концентрации приводили к переуплотнению оболочек икры, что в дальнейшем влияло на процесс выклева личинки. Наибольшую эффективность в борьбе с сапролегниевыми грибами показал 3,0 % раствор препарата «Монклавит-1», однако при дан-ной концентрации зарегистрирован самый низкий уровень выклева личинки (1,8 %).
Положительный результат отмечен при использовании 0,03 % раствора перекиси водорода (снижение процента заражения икры на 8,0 %; по сравнению с другими испытуемыми растворами высокий процент выклева -34,8 %), при этом отмечали действие раствора на оболочку икры. В связи с полученными результатами целесообразно провести эксперимент с перекисью водорода в условиях замкнутого водоснабжения, изменить и расширить спектр ее концентрации, а также применить другую методику обработки.
Заключение
Для борьбы с микромицетами в период инкубации икры проводилась экспериментальная работа по поиску эффективного препарата -аналога органического красителя «Фиолетовый К». Установлено, что использование формалина в качестве препарата для борьбы с сапролегнией в период инкубации икры осетровых видов рыб нецелесообразно, так как данное вещество в испытанных концентрациях обладает сильным токсическим эффектом (100 % гибель личинок после выклева).
Дальнейшая работа с препаратом «Монклавит-1» должна быть связана с использованием новых концентраций и экспозиций для исключения негативного влияния на оболочки икры.
Применение перекиси водорода перспективно (при обработке раствора концентрацией 0,03 % отмечено наименьшее количество икры, зараженной микромицетами), но имели место патологии при инкубации (остановка эмбрионального развития), поэтому необходимо апробировать растворы перекиси водорода наименьших концентраций при более длительной экспозиции.
Испытания препарата «Монклавит-1» и перекиси водорода должны проводиться в условиях замкнутого водоснабжения для максимального приближения к условиям инкубации икры на рыбоводных заводах.
Список литературы
1. Акимова Н. В. Атлас нарушений в гаметогенезе и строении молоди осетровых. / Н. В. Акимова, В. Б. Горюнова, Е. В. Микодина, М. П. Никольская, Г. И. Рубан, С. А. Соколова, В. Г. Шагаева, М. И. Шатуновский. М.: Изд-во ВНИРО. 2004. 120 с.
2. Головина Н. А. Ихтиопатология. / Н. А. Головина, Ю. А. Стрелков, В. Н. Воронин, П. П. Головин, Е. Б. Евдокимова, Л. Н. Юхименко. М.: Мир. 2003. 448 с.
3. Инструкция по химическому анализу воды прудов: Утв. М-вом рыб. хоз-ва СССР 20.03.84, 2-е изд., доп. М.: Изд-во ВНИИПРХ. 1985. 46 с.
4. Кузнецова Е. В. Применение препарата «Монклавит-1» для лечебно-профилактической обработки икры при сапролегниозе / Е. В. Кузнецова, Т. А. Нечаева, М. В. Мосягина, А. А. Печенкина. // Ученые записки УО ВГАВМ. Т. 52. Вып. 2. 2017. С. 72-76.
5. Ларцева Л. В. Сапролегниоз икры ценных видов рыб при искусственном разведении в дельте р. Волги: таксономия, экология, профилактика и терапия./ Л. В. Ларцева, О. В. Обухова, Ю. В. Алтуфьев. Астрахань: ИП Сорокин Р.В., 2017. 98 с.
6. Ларцева Л. В. Профилактика и терапия сапролегниоза осетровых и белорыбицы при искусственном их разведении /Л. В. Ларцева. Автореф. дис... канд. биол. наук. М., 1987. 24 с.
7. Литвинов М. А. Методы исследования микроскопических грибов пресных и соленых водоемов. / М. А. Литвинов, И. А. Дудка. Л.: Наука, 1975. 150 с.
8. Отраслевой стандарт ОСТ 16372-87 Вода для рыбоводных хозяйств. Общие требования и нормы. От 1 апреля 1988. [утвержден Министерством рыбного хозяйства СССР (Минрыбхоз СССР)] [Электронный ресурс] - URL: https://standartgost.ra/ g/%D0%9E%D0%Al %D0%A2_l 5.372-87.
9. Приказ министерства сельского хозяйства РФ № 377 от 25 августа 2015 г. «О внесении изменений в Методику расчета объема добычи (вылова) водных биологических ресурсов, необходимого для обеспе-чения деятельности рыбоводных хозяйств, при осу-ществлении рыболовства в целях аквакультуры (ры-боводства), утвержденную приказом Минсельхоза России от 30 января 2015 г. № 25».
10. ПриказРоссельхознадзора№ 191 от 19.04.2012г. № 191 «О лицензировании фармацевтической деятельности», с изменениями и дополнениями от 18.05.2012 г.
11. Рахконен Р. Здоровая рыба. Профилактика, диагностика и лечение болезней. / Рахконен Р., Веннерстрем П., Ринтамяки-Киннунен П., Каннел Р. Хельсинки: НИИ охот, и рыб. хоз-ва Финляндии, 2003. 180 с.
12. Рекомендации по организации противопаразитарных обработок в рыбоводстве от 7.10.1999 г.
13. Сборник инструкций и нормативно-методических указаний по промышленному разведению осетровых рыб в Каспийском и Азовском бассейнах. М.: Изд-во ВНИРО. 1986. 271 с.
14. Нечаева Т. А., Кузнецова Е. В., Варюхин А. В., Петропавловский А. Г. Способ повышения сопротивляемости икры к заболеваниям [Электронный ресурс] -URL: http://www.freepatent.ru/patents/2421987 - 29.10.2018 г.
15. ТР ЕАЭС 040/2016. Технический регламент Евразийского экономического союза «О безопасности рыбы и рыбной продукции» (принят Решением Совета Евразийской экономической комиссии 18.10.2016 г. № 162).
16. ФЗ «О лицензировании отдельных видов деятельности» от 04.05.2011 г. № 99-ФЗ, с изменениями и дополнениями от 03.08.2018 г.; приказа Россельхознадзора от 19.04.2012 г. № 191.
17. Флоринская А.А. Материалы по видовому составу и экологии плесниевых грибов - возбудителей сапролегниоза рыб в Ленинградской области. / А. А. Флоринская // Известия ГосНИОРХ, 1969. Т. 69. С. 103-123.



