Стенли Маркс,
Профессор ветеринарии мелких животных, BVSc, PhD, Dipl. ACVIM (онкология), Dipl. ACVN
Робин Хьюстон, MS
Университет Калифорнии, Дэвис, ветеринарная клиническая больница, Дэвис, Калифорния, США
Оптимизация процедур исследования каловых масс на наличие кишечных паразитов у собак и кошек
Большее число яиц, цист и ооцист паразитов можно получить методом центрифугирования с флотацией, который также обеспечивает меньшую, чем пассивная (гравитационная) флотация (например, Ovassay®, Fecalyzer®, Ovatector®), частоту выявления ложно-отрицательных результатов (1). Флотацию каловых масс для выявления яиц, цист и ооцист следует проводить со свежими (менее 2 ч после получения) образцами каловых масс. Если это невозможно, образец для исследования следует заморозить. Во всех случаях следует применять метод Бермана (Baermann technique) и приготовлять нативный мазок (влажный препарат). Для сохранения целостности цист Giardia более других методов флотации эффективно применение раствора сульфата цинка с удельным весом 1,2. Более тяжелые яйца паразитов, например, рода Таеп'ш, лучше всего выявлять с помощью раствора сахара (модифицированный раствор Ш итера — Sheather) с более высоким удельным весом, равным 1,27. Выявление Giardia и Cryptosporidium spp. можно ускорить с помощью представленных на рынке наборов для проведения теста ELISA или иммунофлуоресцентного анализа (IFA).
Процедура центрифугирования с флотацией с качающейся головкой
1. Подготовить взвесь 2-5 г каловых масс в 10 мл раствора для флотации.
2. Перелить взвесь через чайное ситечко или марлю в лабораторный стакан или чашку для анализа фекальных масс.
3. Перелить отстоявшийся раствор в коническую пробирку для центрифугирования емкостью 15 мл.
4. Наполнить пробирку средой для флотации, чтобы образовался слегка выбухающий мениск.
5. Закрыть пробирку покровным стеклом и установить ее в центрифугу.
6. Уравновесить центрифугу, провести центрифугирование при 1 200 об/мин (280 X г) в течение 5 минут
7. Извлечь пробирку и выдержать ее в течение 10 минут.
8. Осторожно удалить покровное стекло и разместить его на предметном стекле.
9. Систематично просмотреть всю поверхность покровного стекла через 10Х объектив. Для подтверждения выявленных объектов и, при необходимости, подсчета числа микроорганизмов использовать 40Х объектив.
Процедура центрифугирования с флотацией с фиксированным углом
Провести этапы 1-3, какописановыше, за исключением того, что пробирку для центрифугирования необходимо заполнить только на 3/4. Не закрывать пробирку покровным стеклом. После центрифугирования мениск можно поднять в верхнюю часть пробирки, осторожно добавив пипеткой в нижнюю часть пробирки раствор для флотации, стараясь как можно меньше взбалтывать ее содержимое. Формируется положительный мениск, следует на 10 минут поместить покровное стекло, после чего перенести его на предметное стекло для исследования.
Перенос мениска
Мениск следует переносить, подняв покровное стекло непосредственно с поверхности жидкости после 10 минут инкубации и разместив его на предметном стекле. Наименее эффективный метод переноса мениска — это использование петли или стеклянной палочки, поскольку при этом чувствительность флотации, независимо от метода ее проведения, снижается, и на предметное стекло для исследования попадает только небольшая часть выделенных паразитов.
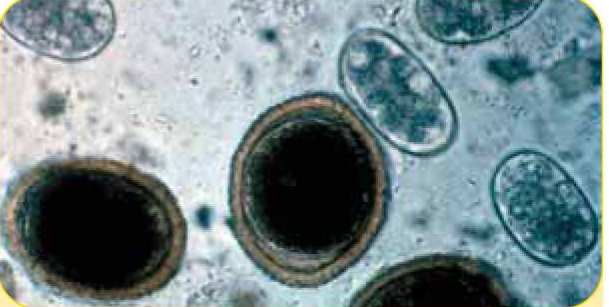
Яйца Toxocara amis, (три крупных округлых объекта), размером 85 х 75 мкм, и яйца нематоды Ancylostoma caninum (два овоидных объекта) размером 60 х 43 мкм.
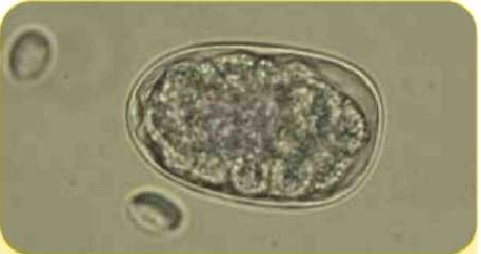
Яйцо нематоды Uncmariastenocephala (75 х 45 мкм) и на фоне — менее крупные шсты Giardia {18 х 10 мкм)
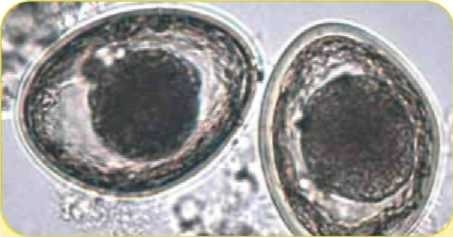
Яйца нематоды Toxascaris leonina (80 х 70 мкм)
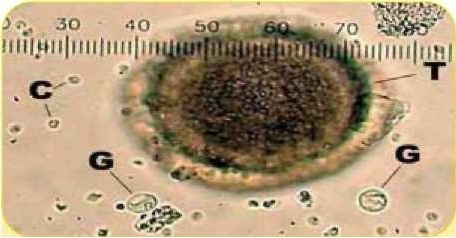
Яйцо нематоды Toxocara spp. (Т), ооциста Cryptosporidium spp. (С), циста Giardia spp. (G)
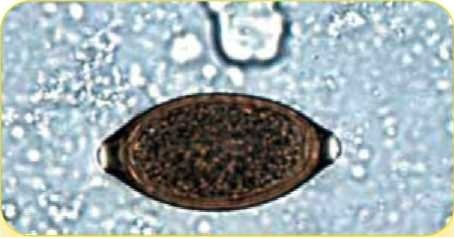
Яйцо хлыстовика Trichuris vulpis (80 х 38 мкм)
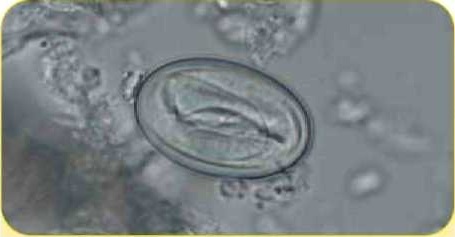
Яйцо желудочного гельминта рода Physaloptera (55 х 32 мкм)
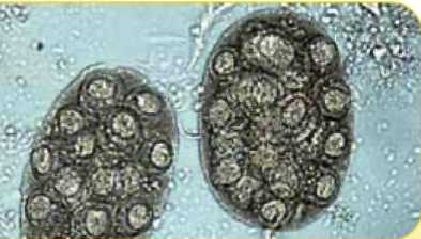
Группа яиц ленточного червя Dipylidium caninum (200 х 150 мкм)
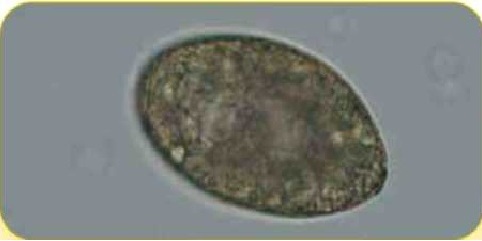
Яйцо трематоды Nanophyetus salmincola (90 х 45 мкм)
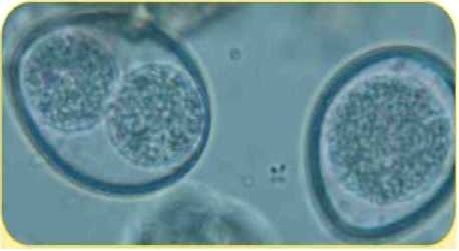
Ооциста Isospom felts (спорулированная и неспорулированная) (42 х 6 мкм)
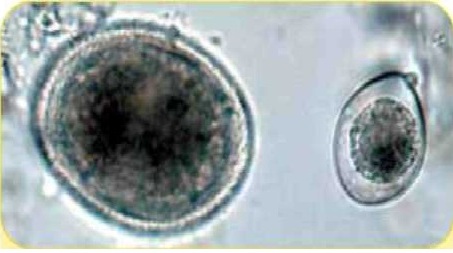
Яйцо нематоды Тохосага cati (75 х 65 мкм) и ооциста Isospora felis(42 х 35 мкм)
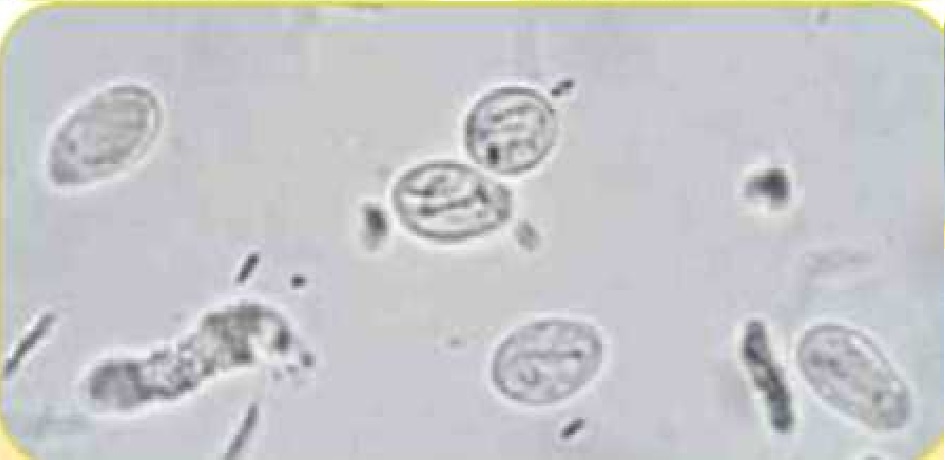
Цисты Giardia spp. (18 х 10 мкм)
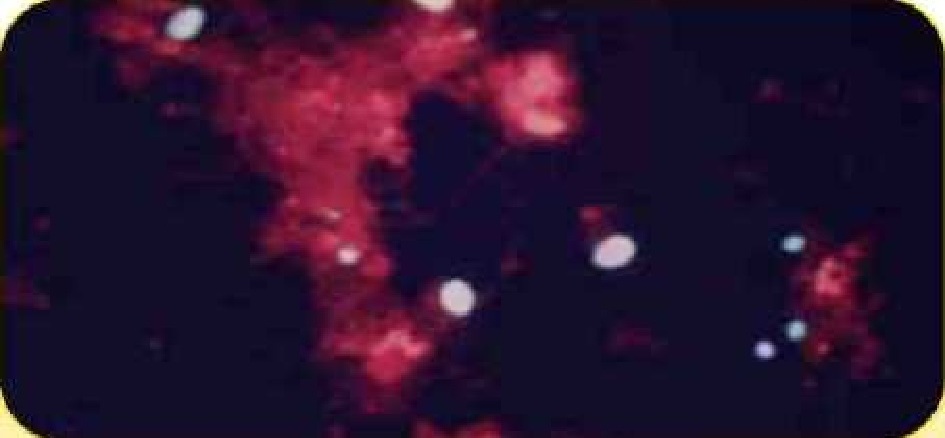
Цисты Giardia spp. и ооцисты Cryptosporidium spp.; визуализация методом иммунофлуоресценции*
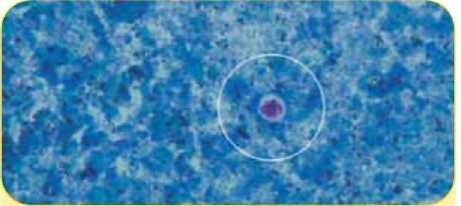
OouwcmCryprosporidium spp.; окрашивание модифицированным методом Циля-Нильсена (5x5 мкм)
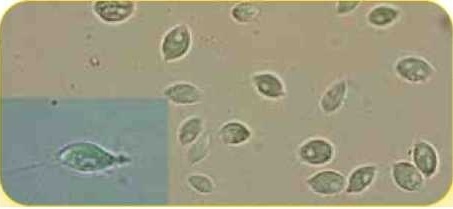
Трофозоиды Tritrichomonas foetus (до 25 х 15 мкм) (увеличение х10О и х400)
Изображение предоставлено компанией Meridian Bioscience Inc., Cincinnati, ОН, США
ЛИТЕРАТУРА
1. DrydenMW, Payne PA, Ridley R, etal. Comparison of common fecal flotation techniques for the recovery of parasite eggs and oocysts. Vet Ther 2005; 6: 14-28.
журнал Vererinary Focus №1 2009



