А.М.ТРЕТЬЯКОВ, П. И. ЕВДОКИМОВ Бурятская ГСХА
Сохранение постоянства нормальной микрофлоры в организме человека и животного закреплено в процессе эволюции и является показателем состояния здоровья, в то время как нарушение сбалансированности экосистемы ведет к появлению дисбиотических реакций и развитию дисбактериоза (А.Ф. Билибин, 1970).
Под дисбактериозом большинство исследователей понимают количественное и качественное изменение нормальной кишечной микрофлоры в сторону увеличения числа микроорганизмов - симбионтов, существующих в норме или встречающихся в незначительных количествах, а также микробного состава толстой кишки. В толстой кишке меняются общее количество и свойства микроорганизмов, усиливаются их патогенность и агрессивность (P.M. Бондаренко, В.Ф. Учайкин, А.О. Мурашова, 1998).
При дисбактериозах характерно снижение уровня бифидо- и лактобактерий, увеличение лактозонегативных кишечных палочек, энтерококков, стафилококков, протея, грибов рода Candida. В их развитии большую роль играют лечебные факторы: применение антибиотиков широкого спектра действия, сульфаниламидов, иммунодепрессантов, гормонов, антисептиков, противоязвенных препаратов, рентгенотерапия, хирургическое вмешательство (A.M. Ариевич, З.Г.Степанищева, 1965; A.M. Галиуллина, Б.А. Галимова И.Н.Фархутдинов, 2000).
Имеются работы, авторы которых отмечают, что под влиянием антгельминтных препаратов (аверсект-2, фасковерм, вермитан, панакур) происходят изменения в функциональной деятельности желудочно-кишечного тракта и нарушения в его установившемся биоценотическом гомеостазе (Н.С. Архипова, 1969; М.П. Арзыбаев, А.Б. Шакиров, 1990).
Так, по данным Х.Г. Нурхаметова (1976), оксиды и оксиниды (дифенилсульфиды) наряду с выраженным гельминтоцидным действием обладают антибактериальными (бактерицидными) свойствами по отношению к S. cholerae suis, S. pullorum, S. typhimurium, а также спорообразующим сапрофитам В. cereus, В. subtilis, В. mesentericus.
A.M. Галиулина и соавт. (2001) установили, что антгельминтики верпанил и фасковерм угнетают пищеварение, нарушают биоценоз, вызывая при этом снижение количества простейших и бактерий, а также их ферментативную активность.
Т.С. Мовик (2002) отмечала, что антгельминтные препараты, воздействуя на желудок и кишечник, оказывают ульцерогенное, геморрагическое, энзимопатическое действие, нарушают моторику кишечника, вызывают дисбактериоз, подавляют нормальную функцию иммунной системы, способствуя образованию антител к лекарственным веществам.
Несмотря на большое количество проведенных исследований, касающихся дисбактериозов кишечника, микробиологические аспекты этой проблемы при терапии противопаразитарными препаратами еще недостаточно изучены. В связи с этим цель нашей работы - изучить влияние антгельминтиков сантел и клозальбен на микробиоценоз кишечника овец.
Материалы и методы. Исследования проводили на 10 годовалых овцах забайкальского типа тонкорунной породы массой тела 35 кг, которых разделили на две группы по 5 гол. в каждой. Животным первой группы назначали сантел в дозе 3,5 мл на животное, подкожно, а второй - клозальбен с кормом из расчета 0,8 г на 10 кг массы тела.
Материалом для исследования служили свежевыделенные фекалии отдельных животных. Все микробиологические манипуляции проводили с соблюдением правил стерильности. Фекалии овец, взятые до утреннего кормления, набирали в пробирки с 1 мл физиологического раствора, далее разводили им же в соотношении 1:9. После гомогенизации полученную взвесь подвергали последовательным десятикратным разведениям со сменой пипеток в физиологическом растворе от 101 до 10'°. Затем по 0,1 мл каждого разведения засевали на чашки с твердыми питательными средами с последующим растиранием шпателем, а по 1 мл - в пробирки с полужидкой питательной средой. Учет результатов проводили для аэробных бактерий через 24 - 48 ч и для анаэробных через 48 - 96 ч культивирования при температуре 37 °С в условиях микроанаэростата. С целью установления видовой принадлежности и изучения биохимических свойств, выделенные микроорганизмы изолировали в чистой культуре, отбирая колонии, лежащие отдельно друг от друга. Выделение и родовую идентификацию бактерий осуществляли в соответствии с методиками, изложенными в рекомендации "Совершенствование микробиологической диагностики дисбактериозов" (К.К. Раевский, В.М. Добрынин, В.И. Кочеровец, 1997).
Для подсчета бифидобактерий разведения фекалий вводили в свежередуцированную среду Блаурокка в модификации ПИ. Гончаровой (1968), разлитую в пробирки высоким столбиком (не менее 10 мл). Колонии бифидобактерий вырастали в виде характерных образований в нижней части посевной среды. При необходимости пастеровской пипеткой отбирали отдельные колонии, которые подвергали микроскопированию. Окрашивали препараты по Граму. Грамположительные клетки с характерными образованиями на концах относили к роду Bifidobacterium. Для подсчета клостридиальных форм бактерий 0,1 мл каждого разведения добавляли в расплавленную и охлажденную до 56 °С среду Вильсона - Блера. После перемешивания среду с посевами в высоком столбике оставляли при комнатной температуре до застывания. Учет результатов осуществляли по количеству черных колоний в толще питательной среды. Микробы семейства Enterobacteriaceae выделяли на средах Эндо, Плоскирева и Левина. На основании морфологии колоний и данных микроскопирования подсчитывали количество кишечных палочек, сальмонелл и протея. Изоляцию стафилококков проводили на желточно-солевом агаре, содержа-
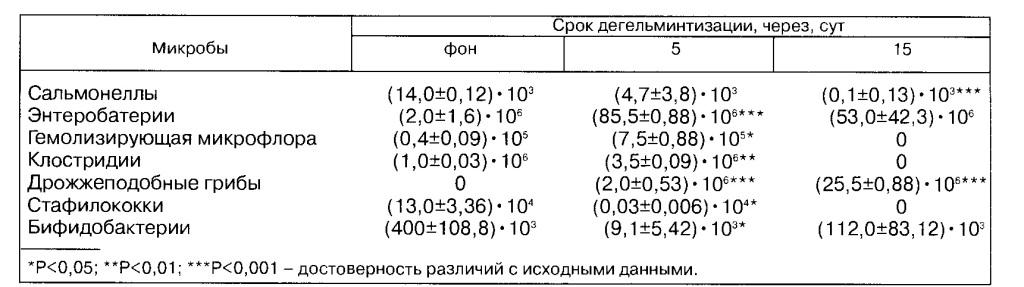
Таблица 1 Динамика микрофлоры кишечника овец под действием сантела, КОЕ/г
щем 7,5 % NaCI, с последующим микроскопированием выросших колоний. Бактерии округлой формы с характерным гроздевидным расположением были отнесены к роду Staphylococcus. Для выделения грибов использовали среду Сабуро с тетрациклином (45 мг/л). Выросшие грамположительные крупные круглой или овальной формы клетки диаметром 2,5 - 6 мкм, дающие на среде Сабуро бесцветные или слабоокрашенные колонии круглой формы в аэробных условиях при 20 - 22 °С, отнесли к грибам рода Candida. Для определения количества гемолизирующей энтеропатогенной микрофлоры использовали 5%-ный кровяной МПА, при этом учитывали только те колонии микроорганизмов, которые образовывали зону гемолиза.
Результаты исследования. До дегельминтизации овец сантелом микробный фон их желудочно-кишечного тракта выглядел следующим образом (табл. 1).
Так, число бифидобактерии в 1 г фекалий равнялось (400±108,8)-105 м. к., сальмонелл - (14,0±0,12) • 103, энтеробактерий (2,0±1,6) • 106, гемолизирующей микрофлоры -(4,0+0,09)-105, клостридии - (1,0±0,03)-106, стафилококков - (13,0±3,36)-104 м.к., дрожжеподобные грибы не высевались.
Через 5 сут после обработки количество бифидобактерии в 1 г фекалий уменьшилось до (9,1+5,42).1О3 м.к., сальмонелл - до (4,7±3,8).1О3 и стафилококков - до (0,03±0,006).104м.к., в то же время число энтеробактерий увеличилось до (85,5±0,88)-10е м.к., гемолизирующей микрофлоры - до (7,5±0,88)-105 и клостридии - до (3,5±0,09)-106 м.к., появились грибы -(2,0±0,53)-106м.к.
Через 15 сут уровень бифидобактерии возрос до (122,0±83,12)-103 м.к., колоний грибов - до (25,5+0,88)-106 м.к., при этом количество сальмонелл сократилось до (0,1 +0,13) • 103 и энтеробактерий -до (53+42,3)- 106м.к., исчезли гемолизирующая микрофлора, клостридии и стафилококки.
Таким образом, антгельминтик сантел на 5-е сутки после дегельминтизации изменяет соотношение ранее сложившегося микробного равновесия в организме овец в сторону достоверного снижения полезной (бифидобактерии) микрофлоры при одновременном увеличении числа условно-патогенных бактерий.
Под влиянием клозальбена микрофлора толстого кишечника овец изменялась следующим образом (табл.2).
До обработки количество бифидобактерии в 1 г фекалий составляло (6,6±0,42)-105 м.к., сальмонелл -(19,3±7,10)-103, энтеробактерий - (47,3±3,4)-105, гемолизирующих форм микробов - (61,0±14,71) • 105, стафилококков - (23,3±7,98)-105 м.к., клостридии и дрожжеподобных грибов не обнаружили.
Таблица 2 Динамика микрофлоры кишечника овец под действием клозальбена, КОЕ/г
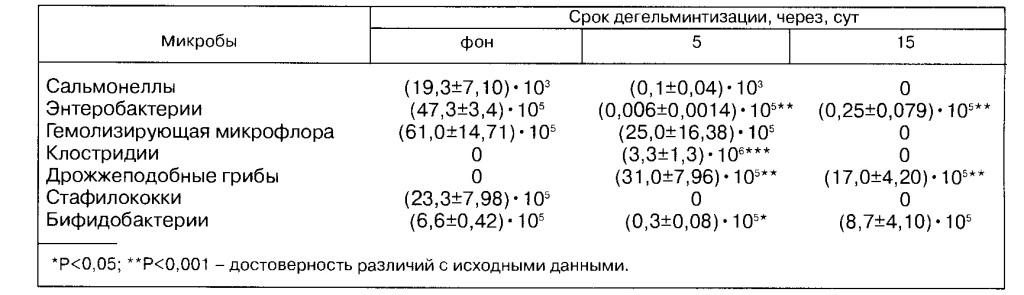
Через 5 сут после введения препарата количество бифидобактерий уменьшилось до (0,3±0,08)-105 м.к., сальмонелл - до (0,1±0,04)-103, гемолизирующей микрофлоры - до (25,0±16,38)-105, энтеробактерий - до (0,006+0,0014)-105 м.к. При этом высевали клостридий в количестве (3,3±1,3) • 106 м.к. и дрожжеподобные грибы - (31,0±7,96) • 105 м. к. в 1 г фекалий, а стафилококки исчезали.
Через 15 сут после дегельминтизации число бифидобактерий возрастало до (8,7±4,10) • 105 м.к., энтеробактерий - до (0,25±0,079)-105 м.к., в то же время количество дрожжеподобных грибов уменьшилось до (17,0±4,20)-105 м. к. в 1 г фекалий, не высевали стафилококков, сальмонелл, клостридий и гемолизирующие формы микробов.
Следовательно, под влиянием антгельминтика клозальбен достоверно снижается число бифидобактерий, на 5-е сутки после дегельминтизации увеличивается количество клостридий и дрожжеподобных грибов, а на 15-е сутки из фекалий овец не высеваются сальмонеллы, клостридий, гемолизирующая микрофлора и стафилококки. Клозальбен в форме порошка оказывает наиболее сильное влияние на численное соотношение микробов кишечника, чем инъекционный препарат сантел.
Заключение. Антгельминтные препараты сантел и клозальбен, широко применяемые в ветеринарной практике, влияют на микробный статус желудочно-кишечного тракта овец, подавляя численность полезной микрофлоры и усиливая рост условно-патогенной, способствуя формированию дисбиотического состояния различной степени. Поэтому при использовании данных препаратов, по нашему мнению, необходимо применять пробиотики, что позволит в кратчайшие сроки нормализовать энтеробиоценоз у животных.
журнал "Ветеринария" №03 2008



