Ногтева И.В., Попрядухин П.В., Петрова НА, Романова О.В., Смирнова Н.В.
РЕЗЮМЕ
Применение регенеративных технологий в отечественной ветеринарной медицине является базой для расширения возможностей терапии, существенного улучшения качества жизни животных и снижения расходов владельцев.
ВВЕДЕНИЕ
Использование современных хметодов регенеративной медицины стало обычной практикой в зарубежной ветеринарии. Технологии клеточной трансплантологии и тканевой инженерии, которые составляют основу регенеративной медицины, позволяют восполнить повреждения полноценными клеточными элементами, а не рубцовой тканью, способствуют восстановлению иннервации и васкуляризации ткани. Это обеспечивает последующую функциональность ткани и снижает вероятность рецидивов. Таким образом, методы регенеративной медицины позволяют добиться результатов в случаях травм и патологий, некурабельных традиционными способами лечения, существенно снижают сроки лечения и реабилитации, ограничивают необходимость применения фармакологических препаратов и позволяют избежать неблагоприятных побочных эффектов, связанных с их применением.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
На примере конкретного клинического случая лечения четырехлетнего мерина можно рассмотреть различные аспекты применения методов регенеративной медицины в травматологии лошадей.
В результате столкновения с автомобилем у коня были раздроблены лицевые кости, через раневое отверстие длиной около 30 см легко просматривались носовые пазухи. К тому же был поврежден правый глаз, но из-за большого отёка и сильного смещения окружающих тканей оценить, насколько он серьёзно травмирован, на тот момент не представлялось возможным (рис. 1).
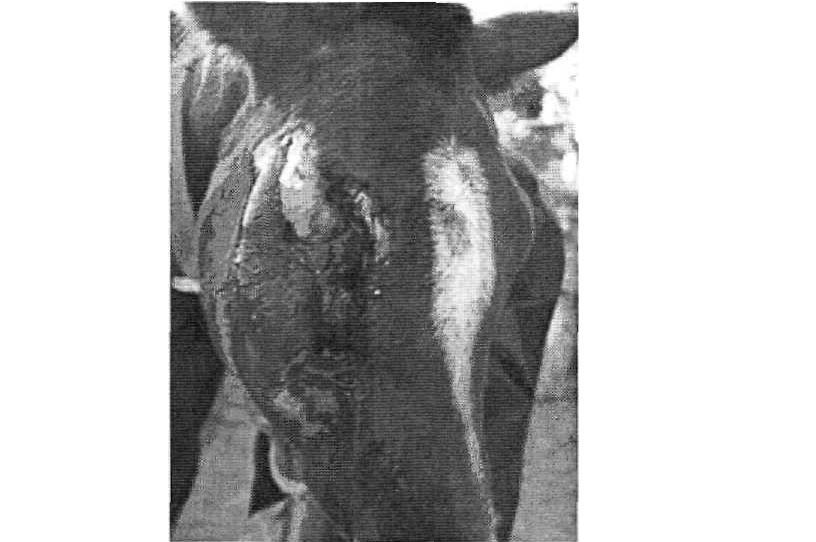
Рис. 1 Повреждения лошади после столкновения с автомобилем
Первоначальнобылапроведенаобработка раны: дезинфекция,устранение осколков костей, дренирование и ушивание. Но повреждение было таким обширным, что кожного лоскута не хватало для закрытия всего дефекта. Пришлось сделать дополнительные послабляющие разрезы, чтобы сблизить края раны (рис. 2).

Рис. 2 После первой операции
Закрыть всю поверхность раны не удалось. Тогда были применены регенеративные технологии. На большой оголенный участок мы наложили губки из биосовместимого и биоразлагаемого материала хитозан (рис. 3 а). Хитозан обладает гемостатическим и антисептическим действием, а также полностью биосовместим. Это делает его отличным кандидатом для использования в качестве основы раневого покрытия (Попрядухин и др., 2011). Этот биоматериал и другие, использованные при дальнейшем лечении лошади, был разработан и синтезирован нашим сотрудником на базе Института высокомолекулярных соединений РАН.
Кроме того, для усиления регенерации мы применили нейтральный гель. В него были введены факторы роста и другие сигнальные молекулы, синтезиро-ванные мезенхимными стволовыми клетками жировой ткани лошади в ходе их культивирования в лаборатории Института цитологии РАН (рис. 3 б). В данном случае для терапии использовались не сами клетки, применяющиеся обычно, а только продукты, которые клетки секретировали в питательную среду. В ряде зарубежных литературных источников показано, что секретированные мезенхимными стволовыми клетками факторы могут снижать апоптоз (клеточную гибель), привлекать и активировать фибробласты и другие клетки, участвующие в регенерации, снижать окислительные повреждения, оказывать антисептическое, стимулирующее рост сосудов и нервных окончаний действие, эффекты, позитивно влияющие на регенерацию тканей (Moon et al., 2012).
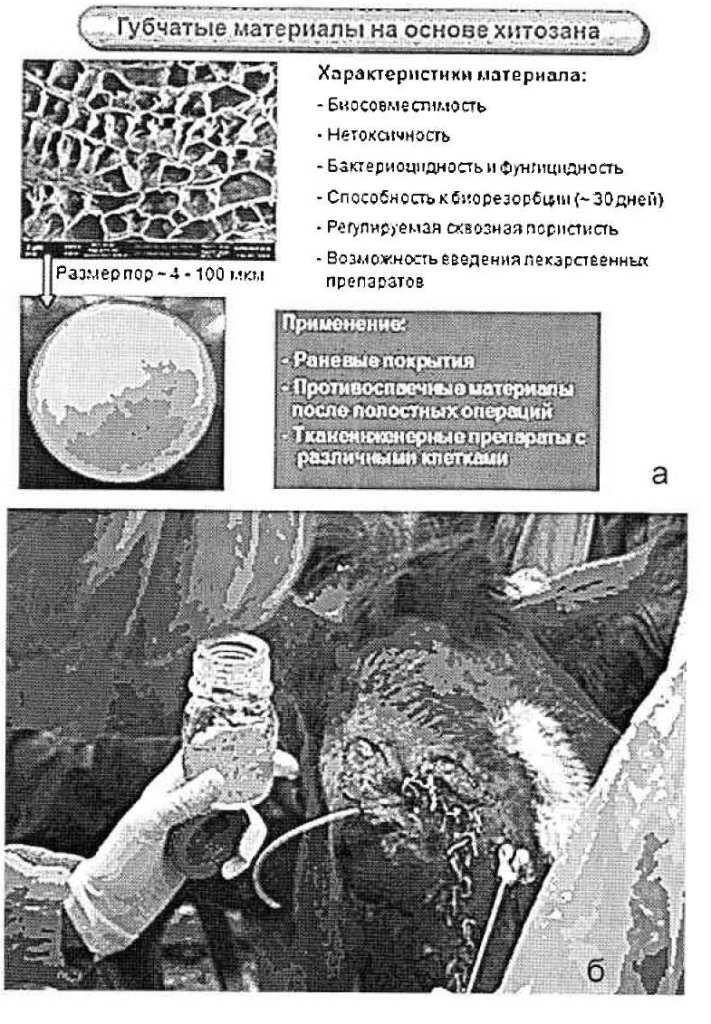
Рис. 3 Раневые покрытия на основе хитозановых губок (а), терапия с помощью регенеративного геля (б)
Через неделю отёки спали. Стало понятно, что правый глаз лечению не подлежит, и спасти его не удастся. Поэтому, глазное яблоко пришлось удалить (рис. 4 а). Однако в целом конь чувствовал себя хорошо, и рака выглядела удовлетворительно. Темпы регенерации повреждений, которые демонстрировал пациент, были достаточно высокими (рис. 4 б).
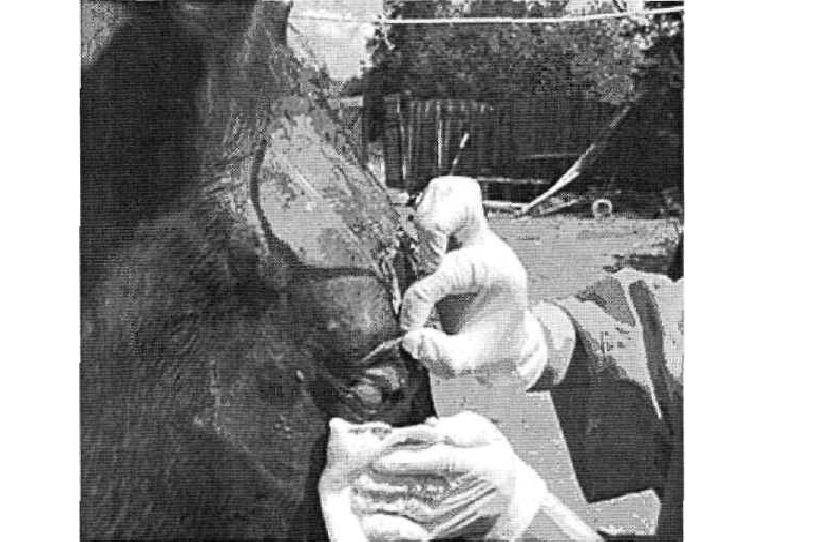
Рис.4 Операция по удалению глазного яблока
Для дезинфекции и окончательного заживления раневых дефектов мы приме-нили методику изготовления фибринового геля на основе собственной крови пациента (рис. 5 а). С использованием двухфазной методики центрифугирования из периферической крови была сепарирована богатая тромбоцитами плазма (БТП). БТП является концентратом исключительно важных для регенерации факторов роста, которые при активации выбрасывают сконцентрированные в плазме тромбоциты (Carter et al., 2003). Кроме того, при активации БТП фибриноген превращается в фибрин, и субстанция становится гелеобразной, что очень удобно для нанесения на раневые дефекты (рис. 5 б.,в). Чтобы не дать гелю быстро высохнуть или сместиться, мы использовали пленочное покрытие из хитозана (рис. 5 г).

Рис. 5 Регенеративная терапия с помощью фибринового геля на основе богатой тромбоцитами плазмы (а), раневое покрытие на основе хитоза-новой пленки (б).
На момент нашего последнего посещения пациента нами не было обнаружено признаков инфицирования и воспаления. Участки, не покрытые кожным лоскутом, демонстрировали высокий темп эпителР1зации и практически зажили (рис. 6 а).

Рис. 6 Через месяц после травмы
Резюмируя данный клинический случай, можно сделать вывод, что применение оперативного хирургического вмешательства и методов регенеративной медицины позволяет добиться хороших результатов лечения даже в случае сложных повреждений.
Травмы сухожильно-связочного аппарата являются серьезной проблемой при содержании лошадей из-за их большой распространенности, отсутствия эффективной диагностики и лечения, необходимости длительной реабилитации и риска рецидивов. Тендинит чаще является болезнью скаковых лошадей, но его проявления могут быть обнаружены у животных и других специализаций. Исследования, проведенные в Великобритании, показали, что из 148 спортивных лошадей у 24% с помощью УЗИ диагностики были обнаружены проявления тендинита различной степени тяжести (Avella et al., 2009).
У спортивных лошадей восстановление связок и сухожилий после травм с помощью традиционных способов лечения - длительный процесс с плохо прогнозируемым и, зачастую, неудовлетворительным результатом. Частым итогом консервативного и хирургического лечения является разрастание в пораженном участке рубцовой ткани, что снижает эластичность связок и сухожилий и ведет к рецидивам при увеличении нагрузок (Smith, 2008). После традиционной терапии повторные травмы случаются в 80 % случаев (Dowling etal. ,2000).
Применение для лечения аутологичных (своих собственных) или аллогенных (донорских) мезенхимных стволовых клеток стало перспективной альтернативой традиционной терапии. Начиная с 2003 г, когда впервые мезенхим-ные стволовые клетки были использованы для лечения травм сухожильно-саязочного аппарата у лошадей, проведены многочисленные исследования, подтвердившие эффективность подобной терапии (Smith et al., 2003; Crovace et al., 2007; Pacini et al., 2007; Smith, 2008; Schnabel et al., 2009). Используется способность стволовых клеток к регуляции воспалительного процесса, снижению окислительных повреждений, стимуляции васкуляризации, межклеточным взаимодействиям и дифференцировке в нужные клеточные элементы.
Для лечения тендинита поверхностного сгибателя пальцев четырехлетней кобылы нами была использована технология получения культуры мезенхим-ных стволовых клеток из жировой ткани (ASCs). Выращенные в достаточном количестве (10 - 15 млн. клеток), ASCs были ресуспензированы в аутологич-ной ТБП, полученной из периферической крови пациента методом двухфазного центрифугирования. Под контролем УЗИ регенеративный препарат был введен в место повреждения.
Анамнез: сильная хромота на левую грудную конечность, горячая и болез-ненная опухоль на пальмарной стороне пясти.
УЗИ диагностика: степень хромоты на момент исследования 2/5. В зоне 2А поверхностного сгибателя пальцев (SDFT) обнаружена значительная без-эховая область. В поперечном сканировании дефект занимал около 50 % от общей толщины сухожилия. В продольном сканировании регистрируется отсутствие или серьезное смещение волокон в том же районе, а также отек окружающих тканей.
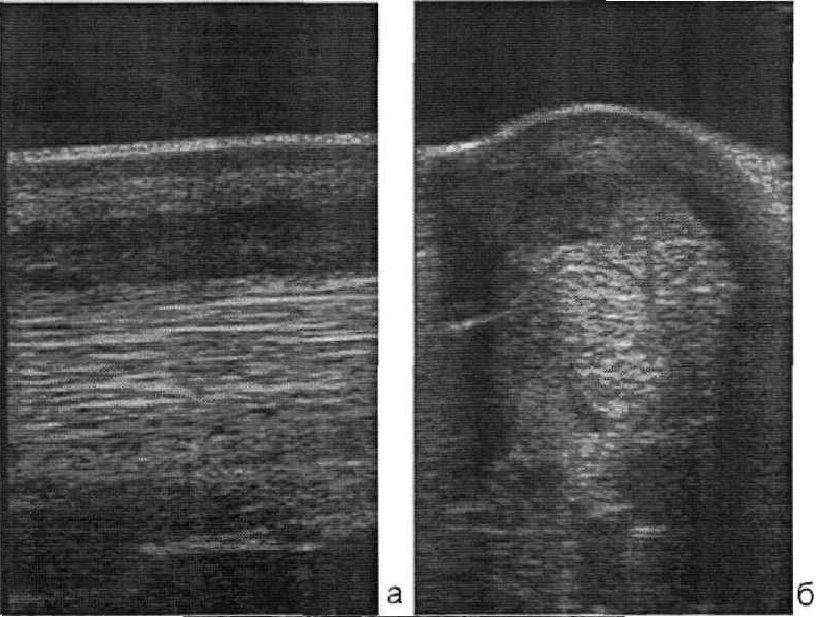
Рис. 7 Повреждение поверхностного сгибателя пальцев. Ультразвуковое сканирование в продольной (а) и поперечной (б) проекции
Диагноз: тендинит поверхностного сгибателя пальцев на левой грудной конечности
Терапия: локальное введение под контролем УЗИ 15 млн. аутологичныхА5С5, ресуспензированных в 5 мл ТБП.
В ТБП тромбоцитов: 1597000/мл, лейкоцитов: 257ОО/мл, в цельной крови: тромбоцитов: 154000/мл, лейкоцитов: 8600/мл
Клиническое течение: через 4 месяца после проведения терапии диагностировали восстановление структуры сухожилия в зоне повреждения.
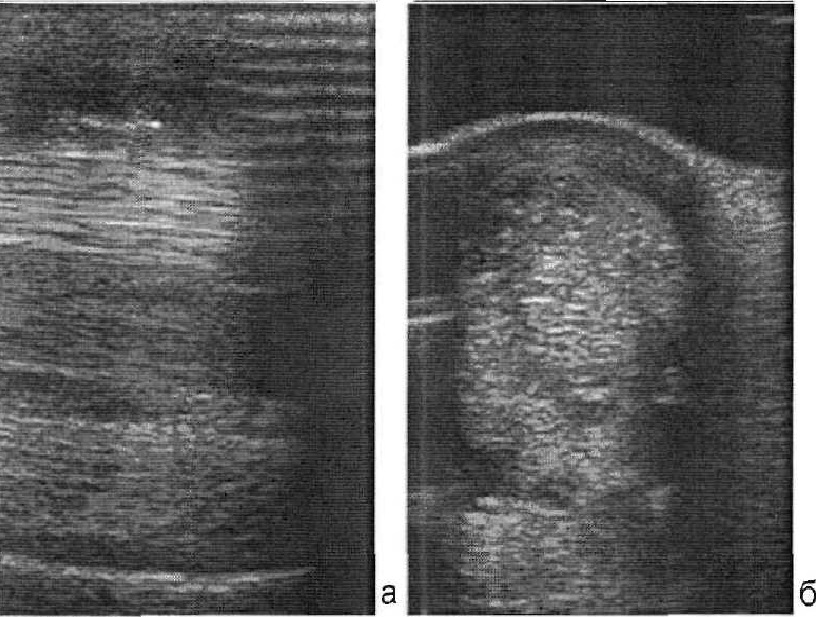
Рис. 8 Восстановление структуры поверхностного сгибателя пальцев через 4 месяца после проведения клеточной терапии.
Ультразвуковое сканирование в продольной (а) и поперечной (б) проекции
Нами получены позитивные результаты при лечении травм связок и сухожилий, особенно если терапия была проведена в первые 2 месяца после травмы. В отличие от традиционных способов лечения, эффект от применения стволовых клеток более продолжительный, что снижает вероятность повторных повреждений до 13-36 % (Smith, 2008). Первые результаты лечения прослеживаются с помощью УЗИ диагностики через 30 - 45 суток после начала терапии. Полная реабилитация достигается через 6-12 месяцев в зависимости от индивидуальных особенностей лошади.
ЗАКЛЮЧЕНИЕ
Таким образом, более активное применение регенеративных технологий в отечественной ветеринарной медицине является базой для расширения возможностей терапии, существенного улучшения качества жизни животных и снижения расходов владельцев.
ЛИТЕРАТУРА
1. Попрядухин П. В., Добровольская И. П., Юдин В. Е., Иванькова Е. М., Смолянинов А. Б., Смирнова И. В. 2011. Композитные материалы па основе хитозана и монтмориллонита: перспективы использования в качестве матриц для культивирования стволовых и регенеративных клеток. Цитология. 53 (12) : 952-958.
2. Avella, С. S., Ely, E. R., Verheyen, К. L. P., Price, S., Wood, J. I. N. & Smith, R. K. W. 2009. Ultrasonographic assessment of the superficial digital flexor tendons of National Hunt racehorses in training over two racing seasons Equine Vet J. 41(5), 449-54.
3. Carter CA. Jolly DG. Warden CF. Sr. Hendren DG. Kane Cl. 2003. Platelet rich plasma gel promotes differentiation and regeneration during equine wound healing. Exp Mol Pathol 74:244-255.
4. Crovace,A., Lacitignola,L, De,S.Rr, Rossi,G., and Francioso,E. 2007. Cell therapy for tendon repair in horses: an experimental study. Vet. Res. Commun. 31 Suppl 1, 281-283.
5. Dowling,B.A., Dart,A.J.t Hodgson,D.R., and Smith,R.K. 2000. Superficial digital flexor tendonitis in the horse. Equine Vet J. 32, 369-378.
6. Moon, KM.; Park, Y.-H.; Lee, J.S.; Chae, Y.-B.; Kim, M.-M.; Kim, D.S.; Kim, В.-Ш; Nam, S.-W.; Lee, J.-H. 2012. The Effect of Secretory Factors of Adipose-Derived Stem Cells on Human Keratinocytes. Int. J. Mol Set 13, 1239-1257.
7. Pacini,S., Spinabella,S., TrombifL, Fazzi,R., Galimberti,S., D'mi,F., Carlucci,F., and Petrini,M. 2007. Suspension of bone marrow-derived undifferentiated mesenchymal stromal cells for repair of superficial digital flexor tendon in race horses. Tissue Eng 13, 2949-2955.
8. Schnabel,L.V., Lynch,M.E., van der Meulen,M.C, Yeager,A.E., Kornatowski,M-A., and Nixon,A.]. 2009. Mesenchymal stem cells and insulin-like growth factor-I gene-enhanced mesenchymal stem cells improve structural aspects of healing in equine flexor digitorum superficial tendons, f. Orthop. Res. 27(10), 1392-1398.
9. Smith,R.K. 2008. Mesenchymal stem cell therapy for equine tendinopathy. Disabil. Rehabil. 30, 1752-1758.
10. Smith,R.K., Korda,M.t Blunn,G.W., and Goodship,A.E. 2003. Isolation and implantation of autologous equine mesenchymal stem cells from bone marrow into the superficial digital flexor tendon as a potential novel treatment. Equine Vet. J. 35, 99-102.
журнал "Иппология и ветеринария" №3 2012



