В.И. БАЛЫШЕВА, А.А. ШИШКОВА, В.И. ЖЕСТЕРЕВ
ВНИИВВИМ
Среди инфекционных заболеваний свиней вирусной этиологии особое место занимают болезни поросят, протекающие в форме энзоотии с высокой смертностью. В первую очередь к ним относятся регистрируемые на территории России и стран СНГ болезнь Ауески и энзоотический (энтеровирусный) энцефаломиелит свиней (болезнь Тешена), которые наносят этой отрасли животноводства большой экономический ущерб. Несмотря на то, что возбудители их вызывают у поросят заболевания со сходными клиническими признаками, характеризующиеся поражением центральной нервной системы, они относятся к разным таксономическим группам вирусов. Так, энтеровирусный энцефаломиелит свиней или болезнь Тешена, вызывает РНК-содержащий вирус семейства Picornaviridae рода Teschovirus, который до 2000 г. относили к энтеровирусам свиней 1-го серотипа. Болезнь Ауески, или псевдобешенство, вызывает ДНК-содержащий вирус семейства Herpesviridae рода Varicellavirus. Учитывая сходство клинических признаков болезней Тешена и Ауески у свиней, окончательный диагноз на эти инфекции ставят по результатам вирусологических и серологических исследований.
Наиболее тяжелое течение болезней Тешена и Ауески отмечают у 2 - 4-месячных поросят. При этом заболеваемость может составлять 50 - 100%, а летальность - 30 - 80%. Для борьбы с ними разработаны высокоэффективные живые и инактивированные вакцины [2-5].
Учитывая наличие на территории Российской Федерации неблагополучных по болезням Тешена и Ауески зон, трудность их клинической дифференциальной диагностики, а также большое количество прививок поросят в раннем возрасте, не всегда укладывающиеся в предлагаемые схемы вакцинации, цель наших исследований - разработать ассоциированную инактивированную культуральную вакцину против болезни Ауески и энтеровирусного энцефаломиелита свиней.
Материалы и методы. В экспериментах использовали: вирус болезни Ауески (БА) вакцинные штаммы МК-25 (8 - 10 пассажей в культуре клеток ПСГК-60) с инфекционной активностью 6,33 - 7,0 Ig ТЦД50/см3; Бук-196 (4-й пассаж в ППК) с инфекционной активностью 5,5 Ig ТЦДо/см3; М-Врация (3-й пассаж в ППК) с инфекционной активностью 6,5 Ig ТЦД50/см3; эпизоотические штаммы вируса болезни Тешена (БТ) Закарпатский (27-й пассаж в ПСГК-60) и Навля (8-й пассаж в ПТП) с инфекционной активностью 8,0 - 8,5 Ig ТЦД50/см3; перевиваемые культуры клеток: почки сибирского горного козерога (ПСГК-60 монослойный, ПСГК-60С суспензионный варианты), почки тестикул поросят (ПТП), почки свиньи (ППК-Д) и почки сирийского хомячка (ВНК-21); питательную среду Игла (MEM), сыворотку крови крупного рогатого скота; инактиванты: 1,8,3,6-диэндометилен-1,3,6,8-тетразоциклодекан (теотропин, А-24), димер этиленимина (ДЭИ); кроликов массой тела 2,0 - 2,5 кг, свиней - 20 - 25 кг.
При выращивании клеток в круговом монослое в роллерных бутылях посадочную концентрацию доводили до 30 - 200 тыс. кл/см3 (120 тыс. кл/см2), степень заполнения составляла 0,10-0,16 емкости сосуда. Роллерные бутыли вращали вокруг своей оси с линейной скоростью 250 см/ч, что соответствовало угловой скорости 12 об/ч для 0,5 дм3 флаконов и 6 - 8 об/ч для 2,5 и 3,5 дм3 бутылей соответственно.
Инфекционную активность вируса определяли по ЦПД в пробирочной культуре ПСГК-60 при 37 °С. За зараженной культурой наблюдали 2-3 сут. Титр вируса подсчитывали по методу Рида и Менча в модификации И.П. Ашмарина и выражали в Ig ТЦЦ50/см3.
Результаты исследований. Для изготовления инактивированных вакцин требуется большое количество вирусного сырья. Для этого мы изучили вирусрепродуцирующие свойства перевиваемых культур клеток в отношении вирусов БА и БТ. При выращивании штаммов Бук-196, М-Врация, ВГНКИ и МК-25 вируса БА в однослойных культурах установили [1], что штамм МК-25 накапливался на 1,0 -1,5 Ig ТЦД50/см3 больше, чем остальные. Поэтому дальнейшие исследования проводили с этим штаммом. Накопление вируса БТ было практически одинаковым для штаммов Закарпатский и Навля и составляло 7,67 - 8,5 Ig ТЦД50/см3.
Учитывая, что более технологичными являются роллерный и суспензионный способы выращивания клеток и вирусов, отработали условия культивирования вирусов БА и БТ этими методами. При выращивании вирусов БТ и БА в суспензии (ПСГК-60С и ВНК-21/13), а также в круговом монослое (ПСГК-60) в роллерных бутылях инфекционная активность возбудителей была на 0,5 Ig ТЦД50/см3 выше, чем при стационарном методе культивирования.
В сравнительном аспекте изучили кинетику инактивации вирусов БА и БТ ДЭИ (0,1%; 0,3%) и А-24 (0,05%; 0,1%) при 37 °С в течение 6 сут. При инактивации ВБТ А-24 в концентрации 0,1 % через 24 ч остаточную инфекционность не выявляли в 3 последовательных пассажах, в то время как при концентрации 0,05% титр вируса к этому времени составил 1,67± 0,17 Ig ТЦД50/см3. Спустя 48 ч инфекционную активность вируса не обнаруживали. Аналогичные результаты получили и при инактивации вируса болезни Ауески.
Иную картину наблюдали при инактивации вирусов ДЭИ (табл.1). Так, при конечной концентрации ДЭИ 0,1% через 144 ч вирус БТ сохранялся в титре 3,0 Ig ТЦД50/СМ3, и только при увеличении инактиванта до 0,3% через 120 ч остаточную инфекционность вируса не регистрировали. Полная инактивация вируса болезни Ауески наступала через 24 ч при концентрации ДЭИ 0,3% и через 72 ч при концентрации 0,1%.
Таблица 1
Активность вируса в зависимости от времени воздействия инактивантов
|
Время |
ВБА, штаммМК-25 |
ВБТ, штаммЗакарпатский |
||||
|
экспози- |
А-24 |
ДЭИ |
А-24 |
ДЭИ |
||
|
ции, ч |
0,05%|0.1% |
0.1% |
0,3% |
0,05% |0,1% |
0,1% |
0,3% |
|
0 |
8,5 9,0 |
9,0 9,0 |
8,33 8,0 |
8,0 |
8,0 |
|
|
24 |
1,67 0 |
2,5 0 |
1,67 0 |
6,0 |
5,0 |
|
|
48 |
0 0 |
2,5 0 |
0 0 |
6,0 |
4,5 |
|
|
72 |
0 |
0 |
0 |
5,33 |
3,5 |
|
|
96 |
- |
0 |
- |
4,5 |
2,33 |
|
|
120 |
- |
- |
- |
3,5 |
0 |
|
|
144 |
- |
- |
- |
3,0 |
- |
|
|
Примечание. —Неисследовали. |
|
|
||||
На основании полученных данных для приготовления моно- и ассоциированных образцов инактивированных вакцин против БА и БТ выбрали следующие режимы: инактивация А-24 (0,05%) при 37 °С в течение 48 ч для обоих вирусов; инактивация ДЭИ в концентрации 0,1% в течение 24 ч для ВБА и 0,3% в течение 120 ч для ВБТ. Для ассоциированных вакцин использовали те же режимы.
Инактивированные моновакцины против БА из штамма МК-25 и против БТ из штамма Закарпатский, а также ассоциированные вакцины испытали на кроликах и свиньях. Иммунизация кроликов моновакциной против БА, инактивированной ДЭИ, в дозе 1 см3 вызывала образование вируснейтрализующих антител в сыворотке крови животных в титрах: на 21-е сутки - 4,0-4,3 log2 после 1-й иммунизации и на 14-е сутки после 2-й - 4,3 - 6,0 log2 (табл.2). После контрольного заражения вирусом БА, штамм МК-25 в дозе 108 ТЦД60 наблюдали проявление клинических признаков болезни с последующей гибелью кроликов на 6-е сутки.
Таблица 2
Сравнительная оценка иммуногенности инактивированных моновакцин
|
Материал |
|
Титрвируснейтрализующих |
Результат |
|
|
дляимму- |
Инак- |
антител, log2 |
контроль- |
|
|
низации |
тивант |
1 -яимму- |
2-яимму- |
ногозара- |
|
|
|
низация |
низация |
жения |
|
|
Кролики (1 мл) |
|
||
|
ВБА |
А-24 |
5,3-7,3 6,3-7,0 |
0/2 |
|
|
|
ДЭИ |
4,0-4,3 4,3-6,0 |
2/2 |
|
|
ВБТ |
А-24 |
8,0-8,3 Н/и |
Н/и |
|
|
|
ДЭИ |
8,0-8,3 Н/и |
|
|
|
|
Свиньи (2 мл) |
|
||
|
ВБТ |
А-24 |
8,5 Н/и |
Н/и |
|
|
|
ДЭИ |
8,0 Н/и |
|
|
|
Примечание. Н/и |
- неисследовали |
|
||
После иммунизации кроликов вакциной против БА, инактивированной А-24, уровень вируснейтрализующих антител в сыворотке крови на 21-е сутки составлял 5,3 - 7,3 log2, а после 2-й вакцинации на 14-е сутки - 6,3 - 7,0 log2. После контрольного заражения все кролики остались живы.
При однократной вакцинации кроликов моновакцинами против ВБТ, инактивированными А-24 и ДЭИ, уровень вируснейтрализующих антител в сыворотке крови на 28-е сутки был 8,0 - 8,3 log2 (1:256-1:315).
Однократная иммунизация свиней образцами вакцин против ВБТ, инактивированными А-24 и ДЭИ, вызывала у них образование вируснейтрализующих антител в титрах 8,0 - 8,5 log2 соответственно.
Вакцинация кроликов ассоциирован-ной вакциной, инактивированной А-24, в дозе 1 см3 вызывала образование вируснейтрализующих антител в сыворотке крови на 21 -е сутки в титре 6,5 log2 против вирусов БА и БТ (рис.1, А), а после 2-й иммунизации титр антител составлял на 14-е сутки 6,5 log2 против ВБА и 8,3 log2 против ВБТ.
Иммунизация кроликов образцами ассоциированной вакцины, инактивированной ДЭИ, вызывала образование вируснейтрализующих антител против вируса БА в сыворотке крови на 21-е сутки в титре 5 log2 и после 2-й на 14-е сутки - 5,5 log2 , а против ВБТ - соответственно 7 log2 и 8,3 log2 (рис.1,Б). После контрольного заражения на 14-е сутки кролики остались живы без проявления клинических признаков болезни Ауески.
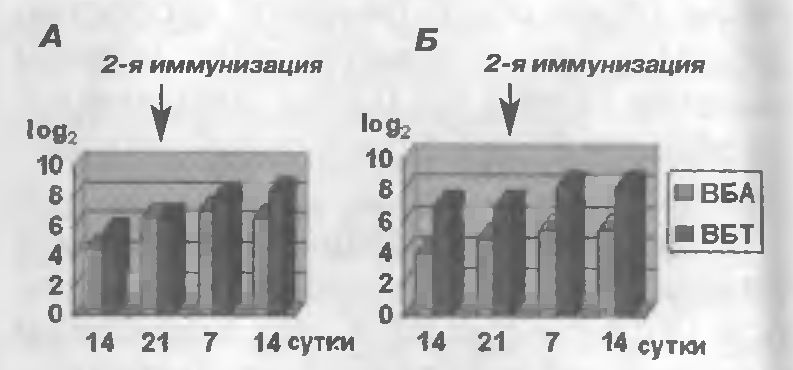
Рис.1 Кинетика накопления вируснейтрализующих антител у кроликов после иммунизации ассоциированной вакциной против БА и БТ, инактивированной: А-А-24; Б-ДЭИ
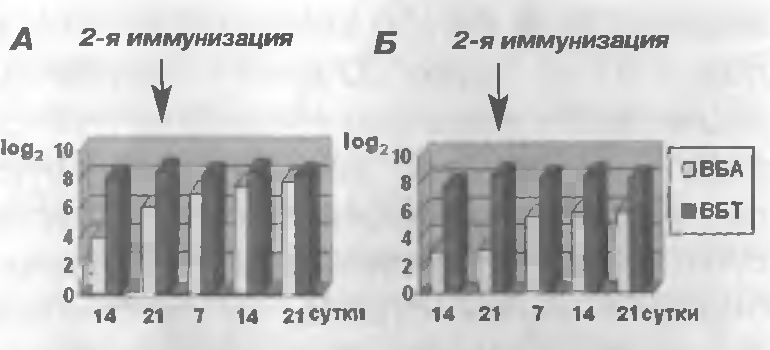
Рис. 2 Кинетика накопления вируснейтрализующих антител у свиней после иммунизации ассоциированной вакциной инактивированной: А - А-24; Б - ДЭИ
При иммунизации свиней ассоциированной вакциной, инактивированной А-24, уровень вируснейтрализующих антител в сыворотке крови против ВБА на 21 -е сутки составлял 6 log2 и против ВБТ - 8,5 log2, а после 2-й на 21-е сутки - соответственно 7,8 log2 и 8,3 log2 (рис.2, А).
После прививки свиней ассоциированной вакциной, инактивированной ДЭИ, титр вируснейтрализующих антител против ВБА в сыворотке крови животных на 21-е сутки был 3,1 log2 и против ВБТ-8,5 log2, а после 2-й - соответственно 5,8 log2 и 8,3 log2 (рис. 2, Б).
При иммунизации кроликов и свиней вакциной, инактивированной А-24, титр вируснейтрализующих антител против ВБА в сыворотке крови животных был выше, чем при прививке вакциной, инактивированной ДЭИ (табл.3).
Таблица 3
Сравнительная оценка иммуногенностм ассоциированных вакцин
|
Инактиви- |
Компо- |
Титрвируснейтрализующих |
Результат |
|
|
рованная |
ненты |
антител, log2 |
контроль- |
|
|
вакцина |
вакци- |
1-яимму- |
2-яимму- |
ногозара- |
|
|
ны |
низация |
низация |
жения |
|
|
|
Кролики (1 |
см3) |
|
|
А-24 |
ВБА |
6,5 |
6,5 |
0/2 |
|
|
ВБТ |
6.5 |
8,3 |
|
|
ДЭИ |
ВБА |
5,0 |
5,5 |
2/2 |
|
|
ВБТ |
7,0 |
8,3 |
|
|
Контроль- |
|
|
|
|
|
ноезара- |
|
|
|
|
|
жение (КЗ)ВБА |
- |
- |
2/2 |
|
|
|
|
Свиньи (2 см3) |
|
|
|
А-24 |
ВБА |
6 |
7,8 |
Н/и |
|
|
ВБТ |
8,5 |
8,3 |
|
|
ДЭИ |
ВБА |
3,1 |
5,8 |
Н/и |
|
|
ВБТ |
8,5 |
8,3 |
|
Заключение. Наиболее технологичными и обеспечивающими максимальное накопление вирусов являются роллерный и суспензионный способы культивирования. Механизм действия инактивантов на вирусы, принадлежащие к разным таксономическим группам, вероятно, различен, что проявляется в скорости их инактивации. Образцы моно- и ассоциированной вакцин, приготовленные с использованием инактивантаА-24, обладают большей иммуногенной активностью и индуцируют образование вируснейтрализующих антител против ВБТ и ВБА в сыворотке крови свиней в титрах 8,0 - 8,5 log2 и 6,0 - 7,8 log2 соответственно.
ЛИТЕРАТУРА
1. Балышева В.И и др. // Материалы Междунар. симпозиума. - Казань, 2005.
2. Малярец П.В. и др. Болезнь Ауески. - Владимир, 1995.
3. Сергеев В.А. и др. // Тез. докл. ВНИИВВиМ. - Покров, 1980.
4. Сергеев В.А. Вирусные вакцины. - Киев: Урожай, 1993.
5. Сюрин В.Н. и др. Вирусные болезни животных. - М.:ВНИТИБП, 1998.
Журнал "Ветеринария" №6 2007



