Н.В. САХНО Орловский ГАУ
Увеличение числа послеоперационных осложнений и случаев длительного заживления ран, переход острого процесса в хронический свидетельствуют о нерешенности проблемы послеоперационной инфекции в хирургии [2]. Несмотря на применение современных мер защиты операционная рана к концу операции часто обсеменяется различной микрофлорой. Однако инфекционный процесс в ней развивается в 2 % случаев и более, так как для этого необходимо, чтобы общее количество микробов превышало 105 — 106 в 1 г ткани. Заражающая доза может быть уменьшена до 10 тыс. микробных клеток при введении микробов с инородным телом, например с хирургической нитью [7].
Одним из путей профилактики нарушения заживления послеоперационных ран является применение шовного материала, который причиняет наименьшее разрушение в прокольном канале, имеет гладкую поверхность, не впитывает жидкость из раны, не разбухает, не подвергается брожению, необъемист и не склеивается со стенками прокола. Он также должен быть биологически активным к инфекции, обладать достаточной растяжимостью, чтобы при нарастающем отеке тканей предупреждать их сдавление и некроз [1, 11].
Кроме того, при остеосинтезе различные типы фиксаторов в силу своих конструктивных особенностей обладают разной степенью стабильности иммобилизации отломков и конфликтности с тканями, что может оказать определенное влияние на течение послеоперационного периода. Поэтому в настоящее время уделяется большое внимание снижению инвазивности имплантантов и применению малоинвазивных способов остеосинтеза [3, 4].
Цель исследования - изучение особенностей микробной обсемененности операционных ран в послеоперационный период у мелких домашних животных после остеосинтеза с применением различных типов фиксаторов и шовного материала.
Материалы и методы. В опытах сформировали 6 групп животных - аналогов обоего пола: в первой - четвертой группах были беспородные собаки, в пятой и шестой - кошки (по 5 гол. в каждой). Под общей анестезией у собак первой и второй групп проводили остеотомию бедренной кости в средней трети ее диафиза под прямым углом, у животных третьей - шестой групп - остеотомию большеберцовой кости под углом 12° к ее длинной оси. Иммобилизацию отломков бедренной кости у особей первой группы осуществляли круглым штифтом, второй группы - стержнем с антимиграционными свойствами нашей конструкции [9]. Отломки большеберцовой кости у собак третьей группы фиксировали стержнем Богданова в сочетании со стягивающими полосами с ограниченным контактом, а четвертой - только последними. Фиксацию отломков большеберцовой кости у кошек обеих групп выполняли проволокой, также обладающей ограниченным давлением на надкостницу. Стягивающие полосы и проволока были наложены циркулярно на диафиз кости в двух местах.
После санации ран, предшествующей их закрытию, для исследования состава микрофлоры в месте оперативного вмешательства брали мазки-отпечатки со дна ран [6]. Операционную рану у собак второй - четвертой групп и кошек шестой группы ушивали нитями "Русар-С" [10] прерывистым узловатым швом. У собак первой группы и кошек пятой группы на мышцы накладывали непрерывные швы из кетгута, а на кожу - прерывистые узловатые швы из шелка (контроль). Всем животным после операции один раз в сутки вводили димедрол из расчета 3,0 мг/кг массы тела и анальгин (0,03 г/кг) в течение 4 дней; аскорбиновую кислоту -2,0 мг/кг массы тела в продолжение 7 дней; линкомицина гидрохлорид - 10,0 мг/кг массы тела в течение 7 дней; кальция глюконат - 1 - 5 мл на животное в продолжение 7 дней и тетравит - 0,05 мл/кг массы тела с интервалом 7 дней (от 3 до 5 инъекций).
В послеоперационный период проводили визуальную оценку состояния ран и швов на месте оперативного доступа: медиальной поверхности голени и области наружного гребня большеберцовой кости; латеральной поверхности бедра и области большого вертела бедренной кости. Устанавливали наличие отечности, гиперемии тканей вокруг ран и количество раневого отделяемого.
Состав микрофлоры ран определяли также на 3-й, 7-е, 10-е и 14-е сутки после операции. После трехкратной обработки кожи вводили между швов до дна раны истонченную конечную часть стерильной одноразовой полиэтиленовой пипетки и брали 0,05 - 0,1 мл отделяемого. По удалении кожных швов на 10-е сутки после остеосинтеза исследовали состав микрофлоры части шовного материала, находящейся наиболее глубоко в операционной ране. Выделение микроорганизмов и определение их чувствительности к антибиотикам проводили согласно рекомендациям (Приказ МЗ от 22.04.1985 [8]).
В первые сутки посев отделяемого из операционных ран проводили на полужидкую среду накопления с тиогликолятом натрия, на 2-е сутки пересевали на кровяной агар, желточно-солевой 10%-ный агар (среда Чистовича) и агар Эндо. При росте на плотных питательных средах изучали микроскопические препараты, окрашенные по Граму, отмечали наличие гемолиза на кровяном агаре, выявляли лецитовителазу (факторы патогенности) на желточно-солевом агаре. Грамположительные диплострептококки отсевали на кровяно-теллуритовый агар для подтверждения принадлежности к стрептококкам и на желчно-кровяной агар, предназначенный для выделения энтерококков. При определении вида стафилококка использовали среды с глицерином, для дифференциации от микрококков - среду с маннитом (определяли аэробную ферментацию маннита для видовой дифференциации стафилококков на первом уровне).
Реакцию плазмокоагуляции с кроличьей плазмой ставили для определения степени патогенности стафилококка и принадлежности его к виду золотистого стафилококка. Выросшие микроорганизмы на агаре Эндо дифференцировали до вида с помощью трехсахарного агара Клиглера, цитратного агара Симмонса, среды с мочевиной по Преусу. Подвижность определяли на полужидком агаре. При отсутствии роста на 3-й сутки посев повторялся до 3-го раза. Далее ставили тесты для подтверждения видового состава выделенных культур, а также определяли их чувствительность к антибиотикам [5, 6, 8]. Результаты исследований и обсуждение. Применение круглых интрамедуллярных штифтов и (или) кетгута и шелка провоцировало заживление ран вторичным натяжением у большинства контрольных животных. У отдельных особей до 14 сут после операции отмечали значительное количество серозно-гнойного экссудата, не купируемого при лечении. Видовой пейзаж микрофлоры операционных ран был представлен стафилококками, стрептококками, энтерококками, эшерихиями (табл. 1). При этом на 3-й сутки после операции были установлены микробные ассоциации в 30 % наблюдений, среди них - Staph. aureus и Str. species, Enterococcus fecalis и Escherichia coli, Staph. epidermidis и Str. species. Среди монокультур у животных обеих контрольных групп стафилококки составляли 85,7 %, стрептококки - 14,3 % наблюдений. При этом были изолированы антибиоти-корезистентные штаммы Staph. epidermidis. Полирезистентности выделенных микроорганизмов к тестируемым препаратам не установили. Частота выделения основных условно-патогенных и сапро-фитных видов бактерий в контроле была в 2,3 раза выше, чем в опытных группах.
Круглые металлические штифты, характеризующиеся нестабильной иммобилизацией отломков (ротационное смещение), и шовный материал с высокой конфликтностью с мягкими тканями могут провоцировать иммунологическую ауто-агрессию клинических штаммов микроорганизмов. В результате этого в отдельных случаях взаимодействие макро- и микроорганизмов характеризовалось развитием гнойных осложнений. Их выявили у 2 контрольных собак, у кошек этого не наблюдали, что, возможно, объясняется меньшим видовым разнообразием микроорганизмов в ранах у последних. Хотя видовой резистентности к контаминации микрофлорой операционных ран нами не установлено.
Таблица 1 Частота выделения микроорганизмов (%) из послеоперационных ран
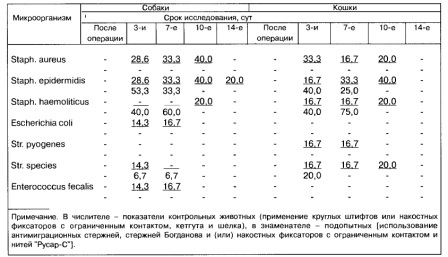
У животных второй - четвертой и шестой групп при стабильном остеосинтезе и использовании нити "Русар-С", способствующей умеренному натяжению швов, заживление послеоперационных ран происходило по первичному натяжению без признаков инфильтрации, в раневом отделяемом было небольшое количество секрета. При этом формировался нежный, легко смещаемый, негипертрофический кожный рубец, фаза гидратации сокращалась. У подопытных животных травмированная конечность включалась в функцию опоры и передвижения на 5 сут раньше по сравнению с контрольными.
В состав бактериальной микрофлоры послеоперационных ран у животных опытных групп входили стафилококки и стрептококки, что характерно для раневого отделяемого. На основании бактериологического контроля течения раневого процесса на 3-й сутки после оперативного вмешательства выявляли присутствие Staph. epidermidis с повышенной чувствительностью к линкомицину (табл. 2). Антибиотикочувствительными микроорганизмами также были Str. species и Staph. haemolyticus. Чистые раны в это время были выявлены в 2 случаях. Полное очищение ран от микроорганизмов у подопытных животных наблюдали на 7-е сутки, у контрольных - на 10-е сутки, а у отдельных особей - лишь на 14-е сутки после оперативного вмешательства.
В целом полученные результаты у животных опытных групп подчеркивают малоинвазивность избранной техники фиксации отломков поврежденных трубчатых костей [антимиграционный стержень, стержень Богданова и (или) накостные фиксаторы с ограниченным контактом], а также шовного материала "Русар-С", что снижает риск инфекционных осложнений. Для консолидации отломков и регенерации мягких тканей были созданы условия, при которых не возникло необходимости дополнительного или дальнейшего лечения.
Выявленное после оперативного вмешательства микроэкологическое состояние у животных опытных групп не провоцировало развития патологического процесса, так как количество микроорганизмов в послеоперационной ране не было достаточным для развития чувства кворума (Quorum sensing), которое работает по принципу автоиндукции и зависит от плотности микробной популяции. Поэтому возможно сокращение сроков консолидации отломков и заживления операционных ран за счет снижения интенсивности работы иммунной системы макроорганизма, направленной на предупреждение развития раневой инфекции.
Следует отметить, что тяжесть операции также может влиять на исход сложившихся паразитохозяйственных отношений макроорганизма и популяций микроорганизмов. Однако заметного отличия по видовому пейзажу микроорганизмов и срокам наступления асептического состояния операционных ран при повреждении разных звеньев периферического скелета не выявили. Это обусловлено тем, что обширность повреждения мягких тканей при оперативном доступе к бедренной кости была дополнена небольшой площадью ее повреждения при поперечной остеотомии. В то время как незначительная травма мягких тканей, сопровождающаяся оперативным доступом к большеберцовой кости, была усугублена значительной площадью нарушения ее целостности, а именно под углом к ее длинной оси.
Установлено также, что использование даже одного из факторов, повышающих инвазивность операции (круглые штифты или кетгут и шелк), способствовало расширению микробного пейзажа послеоперационных ран и удлинению регенеративного периода. В то время как сочетанное применение круглых штифтов, кетгута и шелка не вызывало дополнительной бактериальной обсемененности и не отдаляло сроки реабилитации конечности. По нашему мнению, в
Таблица 2 Антибиотикограмма на 3-й сутки после остеосинтеза
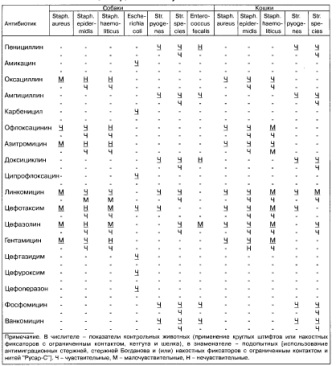
данном случае накопительная система негативных свойств анализируемых имплантантов не имела действия в силу достаточного иммунного ответа у животных, средней степени тяжести хирургического вмешательства и адекватно подобранной послеоперационной терапии.
Заключение. Применение антимиграционных стержней, стержней типа Богданова и (или) малоинвазивных накостных фиксаторов (проволока или стягивающие полосы с ограниченным контактом), а также нитей "Русар-С" не предупреждает развитие условно-патогенной и сапрофитной микрофлоры в операционных ранах. Однако это профилактирует развитие послеоперационных осложнений, а также способствует более раннему асептическому состоянию операционных ран и анатомо-функциональной реабилитации травмированной конечности в среднем на 4 - 5 сут по сравнению с контролем.
ЛИТЕРАТУРА
1. Видении В.Н. //Мат. Междунар. науч.-практ. конф. "Актуальные проблемы ветеринарной медицины", посвящ. 60-летию факультета ветеринарной медицины Ульяновской ГСХА. 2003.
2. Каплан А.В., Махсон Н.Б., Мельникова В.М. Гнойная травматология костей и суставов. - М.: Меди-цина, 1985.
3. Лазарев А.Ф., Солод Э.И., Рагозин А.О. // Вестник травматологии и ортопедии им. И.И. Приорова. 2006. №1.
4. Литвинов И.И., Ключевский В.В. // Вестник травматологии и ортопедии им. И.И. Приорова. 2006. №1.
5. Определитель бактерий Берге / Перев. с англ. под ред. Дж. Хоут, Н. Кригаидр. - М.: Мир, 1997. Т. I, II.
6. Практикум по ветеринарной микробиологии и иммунологии / Т.С. Костенко, Е.И. Скаршевская, С.С. Гительсон. - М.: Агропромиздат, 1989.
7. Раны и раневая инфекция / Под ред. М.И. Кузина, Б.М. Костюченок. - М.: Медицина, 1981.
8. Рекомендации из приказа МЗ от 22.04.1985. "Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений".
9. Сахно Н.В. Фиксатор для интрамедуллярного остеосинтеза у собак и кошек /Пат. №2252731 от27.05.2005.
10. Тарасенко П.А. Сравнительная клинико-морфологическая оценка синтетического материала "Русар-С" при ушивании операционных ран у животных: Автореф. дис. ... д-ра вет. наук. - Воронеж, 2006.
11. Толстых П.И., Арутюнян Б.Н., Стручков Ю.В. и др. Биологически активный шовный материал как средство профилактики нарушений заживления ран. Хирургия. - М.: Медицина, 1980.
Журнал "Ветеринария" №2 2008



