Белова Л. М., Крылов М. В.
ФГБОУ ВПО «Санкт-Петербургская государственная академия ветеринарной медицины» Адрес: 196084, Россия, Санкт-Петербург, ул. Черниговская, д. 5
Введение
Одними из наиболее распространенных и экономически важных паразитарных болезней в птицеводстве считаются кокцидиозы. Потери от кокцидиозов складываются из гибели птиц, снижения продуктивности (отставании в росте и развитии, ухудшении качества тушек, снижении яйценоскости) и дополнительных затрат на единицу продукции [7, 8, 4].
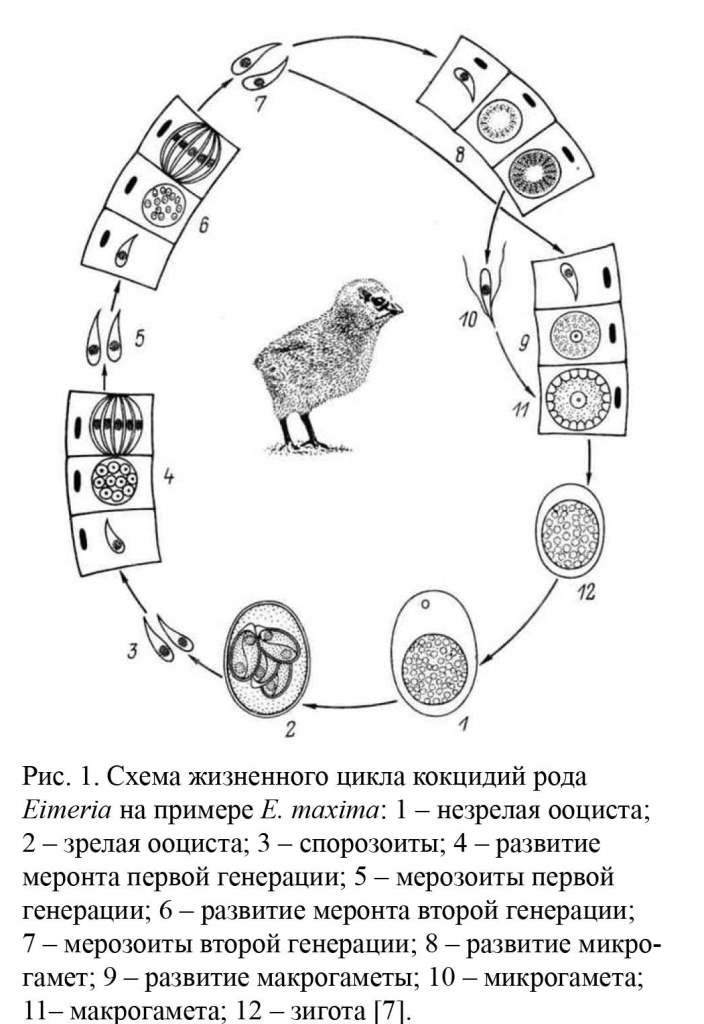
У каждого вида птиц паразитируют присущие только им строго специфичные виды кокцидий. В организме кур размножаются 8 видов кокцидий. Часть жизненного цикла кокцидий протекает в организме птиц (эндогенное развитие), часть - во внешней среде (экзогенное развитие) (рис. 1). Эндогенное развитие завершается формированием расселительных стадий - ооцист, которые вместе с пометом выделяются во внешнюю среду. Ооцисты имеют овальную или круглую форму (рис. 2). Снаружи ооциста покрыта двух- или трехслойной оболочкой, внутри ооцисты (незрелой) имеется зигота, которая под влиянием температуры (оптимальная
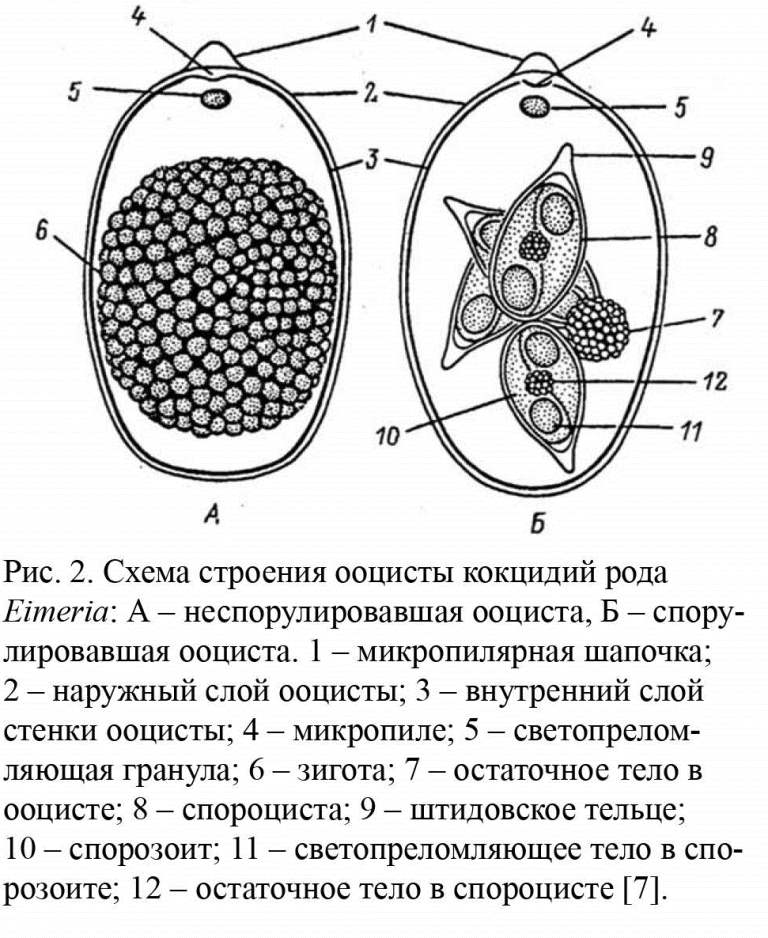
температура 18-24 °С) при наличии кисло-рода и влажности созревает (через 24-96 часов), при этом дробится на четыре споро-цисты, из которых каждая дает начало двум спорозоитам. Таким образом стадии, инвазирующие организм птиц, спорозоиты имеют два защитных барьера, предохраняющие их от вредно действующих факторов внешней среды - оболочки спороцисты и оболочки ооцисты. Экзогенные формы (ооцисты) могут длительное время (по некоторым наблюдениям свыше года) находиться во внешней среде, сохраняя способность инвазировать своих хозяев. Попав в организм птиц вместе с загрязненным кормом или питьевой водой, из зрелых ооцист в кишечнике птиц выходят спорозоиты и внедряются в эпителиальные и другие клетки стенки кишечника. В клетке хозяина спорозоит начинает расти и размножаться множественным делением, формируя многоядерное образование - меронт. Меронт распадается на огромное число одноядерных особей - мерозоитов. Мерозоиты выходят в просвет кишечника и опять внедряются в клетки хозяина, повторяя вышеописанный способ размножения. Такое размножение может повторяться несколько раз, наконец, мерозоиты второй или третьей генерации, внедряясь в клетки хозяина, дают начало новой фазе развития - гаметогонии. При этом образуется множество мелких длинных мужских особей паразитов с двумя жгутиками - микрогамет, часть же мерозоитов превращается в крупные овальные женские особи - макрогаметы. Микрогаметы копулируют с макро-гаметами, образуя зиготу, зигота покрывается оболочками и превращается в ооцисты, ооцисты выпадают в просвет кишечника и перистальтикой выносятся во внешнюю среду, на этом заканчивается эндогенное развитие [2, 7, 8].
Период от момента заражения до по-явления первых ооцист называется пре-патентным, а период выделения ооцист -патентным. Экзогенные стадии хорошо культивируются с добавлением 2 % раствора двухромовокислого калия. Эндогенные стадии некоторых видов кокцидий культивируют на куриных эмбрионах и культурах тканей. Кокцидий обладают высокой репродуктивной способностью. В экспериментах с заражением цыплят одной ооцистой Eimeria tenella формируется от 400 тыс. до 2.5 млн ооцист, Е. acervulina - 72 тыс., Е. necatrix -58 тыс., Е. maxima - 12 тыс. [5].
Виды кокцидий, паразитирующие у кур
Кокцидий, паразитирующих у кур, относят к семейству Eimeriidae. Болезни, вызы-ваемые кокцидиями этого семейства, обычно называют эймериозами. У кур паразитирует 8 видов кокцидий, из них наибольшее практическое значение имеют: Eimeria tenella, Е. acervulina, E. maxima, E. mitis, E. necatrix, Е. praecox [7, 8, 10].
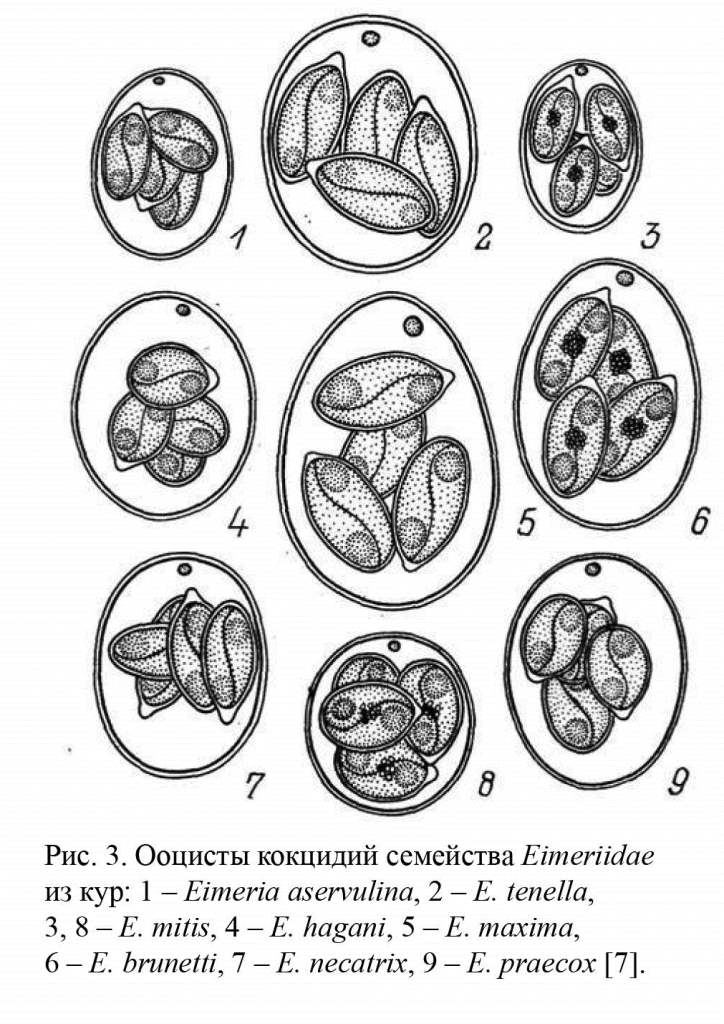
Eimeria tenella (рис. 3, 2).
Распространение: всесветное.
Описание. Ооцисты широкоовальные 14-31 х 9-25 (22,9 х 19,1) мкм, большинство спорулировавших ооцист содержат свето-преломляющую гранулу, расположенную, как правило, полярно. Спороцисты имеют штидовские тельца. Спорозоиты запятовидной формы.
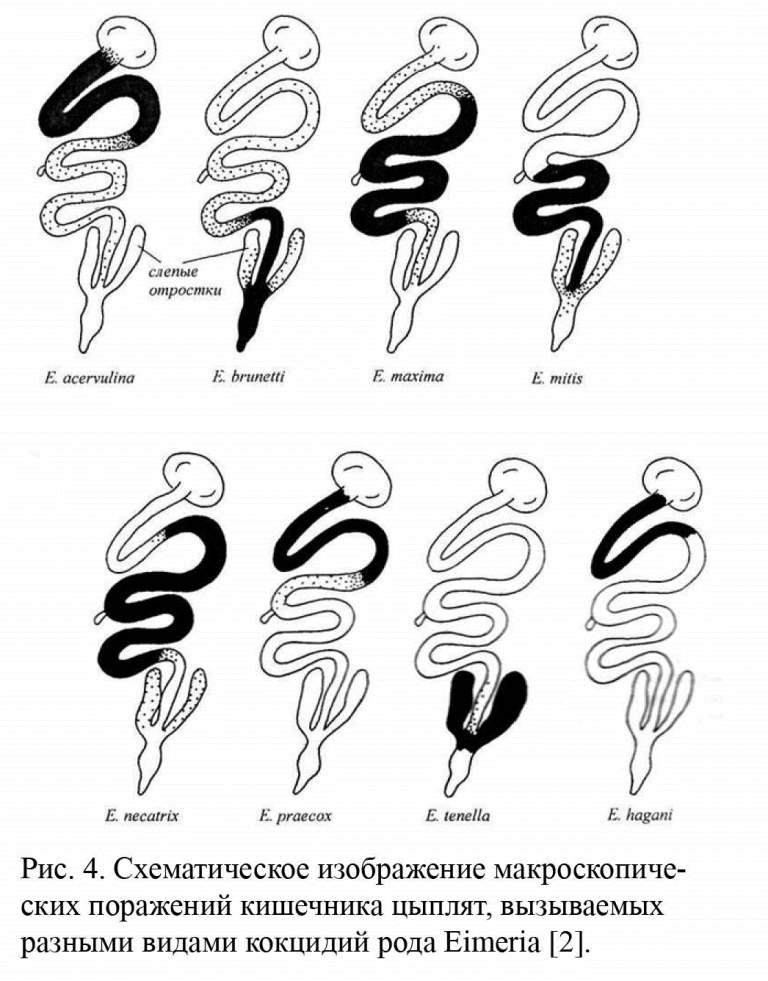
Эндогенные стадии развиваются в слепых кишках, реже в задней части тонкой кишки и прямой кишке (рис. 4). Описаны три генерации меронтов. Гаметогония начинается на 6-й день после заражения.
Время споруляции при 24 °C — 2 дня, пре-патентный период - 6-7 дней, патентный -10 дней.
Eimeria acervulina (рис. 3,1).
Распространение: всесветное.
Описание. Ооцисты овальные 12—23 х 9—17 (16 х 13) мкм. Стенка ооцист состоит из двух слоев, гладкая, утончается на одном из полюсов. У большинства ооцист имеется светопреломляющаяся гранула, чаще наблюдаемая в неспорулированных ооцистах. Спороцисты овальные.
Эндогенные стадии развиваются в перед-ней части тонкой кишки (рис. 4). Развивается четыре генерации меронтов. Гаметогония начинается через 80—120 ч после заражения.
Время споруляции при 22 °С - 1 день, препатентный период — 4 дня.
Eimeria maxima (рис. 3, 5).
Распространение: всесветное.
Описание. Ооцисты овоидные 21-42 х 16-30 (29,3 х 22,6) мкм, содержат светопреломляющую гранулу. Стенка ооцист желтоватого цвета, слегка шероховатая, состоит из
двух слоев. Спороцисты продолговато-овоидные имеют штидовские тельца.
Эндогенное развитие проходит вдоль всей тонкой кишки (рис. 4). Описаны две генерации меронтов. Гаметогония обнаруживается через 120 ч после заражения.
Время споруляции - 1,5-2 дня.
Препатентный период - 5-6 дней.
Eimeria mitis (рис. 3, 3, 8).
Распространение: всесветное.
Описание. Ооцисты сферические или эллипсоидные 10-21 х 9-18 (16 х 13) мкм. Стенка ооцист гладкая, бесцветная. В ооцисте присутствует светопреломляющая гранула. Спороцисты имеют штидовские тельца и остаточные тела.
Эндогенное развитие проходит вдоль всего кишечника (рис. 4). Описаны четыре генерации меронтов. Гаметогония протекает по всему кишечнику.
Время споруляции при 29 °С - 11-12 часов, при 15-16 °С - 2 дня, препатентный период - 4-5 дней.
Замечания. На основании изучения размеров ооцист, электрофоретической подвижности ферментов, способности развиваться в эмбрионах кур и наличия перекрестного иммунитета между штаммами Eimeria mivati и Е. mitis сделано заключение, что Е. mivati и Е. mitis - один вид [11]. На основании этой работы название Е. mivati нужно считать младшим синонимом Е. mitis [7].
Eimeria necatrix (рис. 3,7).
Распространение: всесветное.
Описание. Ооцисты продолговато-овальные 12-29 х Ц-24 (20 х 17) мкм. Стенка ооцист тонкая, гладкая. Ооциста содержит светопреломляющую гранулу. Спороцисты продолговатоовоидные, одни исследователи отмечают наличие остаточных тел в спороцисте, другие не находят их.
Эндогенные стадии развития проходят вдоль всей тонкой кишки (рис. 4). Описаны три генерации меронтов.
Время споруляции при 24 °С - 1-2 дня, препатентный период - 6-7 дней, патент-ный- 12 дней.
Eimeria praecox (рис. 3, 9).
Распространение: всесветное.
Описание. Ооцисты сферические или эллипсоидные 16-25 х 15-20 (20,4 х 17,5) мкм. Стенка ооцист гладкая, бесцветная. В спорулированных ооцистах имеется светопреломляющая гранула.
Мерогония. Известны три генерации меронтов. Гаметогония начинается через 83 ч после заражения (рис. 4).
Время споруляции - 1-2 дня, препатент-ный период - 4 дня, патентный - 10 дней.
Eimeria hagani (рис. 3,4).
Распространение: всесветное.
Описание. Ооцисты широкоовальные 16-21 х 14-19 (19,1 х 17,6) мкм. Стенка ооцист гладкая, состоит из двух слоев. В спорулированных ооцистах имеется светопреломляющая гранула.
Мерогония протекает в передней половине тонкой кишки (рис. 4).
Время споруляции - 1-2 дня, препатентный период - 6 дней, патентный - 8 дней.
Eimeria brunetti (рис. 3,6).
Распространение: всесветное.
Описание. Ооцисты овальные 14-34 х 12-26 (23 х 20) мкм. Стенка ооцист гладкая, тонкая, состоит из двух слоев. В ооцисте имеется 1-2 светопреломляющие гранулы. Спороцисты продолговато-овоидные, имеют штидовские тельца. В спороцистах имеются остаточные тела.
Эндогенные стадии развиваются в прямой кишке (рис. 4). Известны две генерации меронтов.
Время споруляции при 30 °С - 1-2 дня, препатентный период - 5 дней, патентный -10 дней.
Источники и пути заражения
Трансовариально кокцидии не переда-ются, только что вылупившиеся цыплята свободны от кокцидии. Заражение птиц кокцидиями происходит через загрязненные ооцистами предметы внешней среды, корм и воду. В загрязнении внешней среды экзогенными стадиями кокцидии повинны не только молодые птицы, больные кокцидиозом, но и взрослые птицы, не проявляющие клинических признаков кокцидиоза, по-тому что у них на фоне иммунитета может развиваться некоторое количество ооцист. Перенос ооцист кокцидии из клетки в клетку, из помещения в помещение и из одного хозяйства в другое может осуществляться механическим путем, вместе с предметами ухода, оборудованием, тарой, используемой для перевозки птиц и продуктов птицеводства, а также обслуживающим персоналом, грызунами, синантропными птицами и насекомыми. Продолжительность выживания ооцист во внешней среде может значительно колебаться в зависимости от условий, в которых они находятся. Существенное влияние на переживаемость ооцист во внешней среде оказывают климатические условия. В одних условиях ооцисты кокцидии выживают несколько часов и даже минут, в других могут сохраняться очень длительное время. В зонах с прохладным, влажным летом и суровой зимой ооцисты кокцидии могут переживать более года, в районах с жарким и сухим летом экзогенные стадии кокцидии, как правило, быстро погибают в весенне-летне-осенний периоды. Что касается влияния микроклиматических условий, то наиболее благоприятны для выживания ооцист затемненные, с повышенной влажностью, биотопы.
Клинические признаки
Наиболее восприимчивы к кокцидиозу молодые птицы в возрасте от 7-10 дней до 2-3 месяцев. Инкубационный период при кокцидиозе варьируется от 4 до 7 дней в зависимости от интенсивности заражения и вида возбудителя. Больные птицы угнетены, теряют аппетит, у них появляется жажда, цыплята стремятся к теплу и скучиваются, перья взъерошены, голова втянута, крылья опущены. Появляется диарея, в начале болезни фекалии жидкие, зеленоватого или коричневого цвета, затем в испражнениях появляются сгустки крови и обрывки десквамированного эпителия. В результате больших кровопотерь и интоксикации цыплята становятся анемичными. К концу болезни наступают порезы ног и крыльев. Острое течение болезни, как правило, заканчивается летальным исходом на 2-9 день после появления клинических признаков. Смертность может достигать 100 %.
Патологоанатомические изменения
При вскрытии отмечается общее истощение и анемичность. Слепые кишки геморрагически воспалены и сильно увеличены, в просвете содержатся сгустки крови. Часто бывает геморрагически воспалена слизи-стая оболочка тонкого отдела кишечника. На стенке кишечника со стороны серозной оболочки имеются очажки поражений беловато-сероватого цвета.
Диагностика
Диагноз на кокцидиоз ставят на основа-нии эпизоотологических, клинических, патологоанатомических данных и результатов микроскопического исследования препара-тов. Для обнаружения ооцист в содержимом кишечника обычно исследуют нативные препараты. Для этого содержимое кишечника наносят на предметное стекло, добавляют 2-3 капли физиологического раствора или водопроводной воды, накладывают покров-ное стекло и исследуют при сухих системах микроскопа. Для обнаружения ооцист ино-гда полезно использовать методы концен-трации по Дарлингу и по Фюллеборну. При установлении диагноза на кокцидиоз по ре-зультатам микроскопического исследования необходимо иметь в виду, что обнаружение небольшого количества ооцист не может служить основанием для постановки диагноза, так как только интенсивное заражение вызывает клиническое проявление кокцидиоза. Кроме того, следует учитывать то, что отсутствие ооцист в препарате не является основанием для исключения кокцидиоза, так как при исследовании мог попасть материал от больных птиц, у которых еще не закончилась эндогенная часть цикла развития кокцидии и ооцисты не сформировались. Поэтому при диагностике кокцидиоза необходимо всегда исследовать большое количество проб, полученных от различных птиц, и результаты микроскопии обязательно рассматривать с учетом эпизоотологических, клинических и патологоанатомических данных. Для повторных исследований ооцисты кокцидии можно длительное время сохранять в 2-3 % растворе двухромового кислого калия [8, 5, 1].
Меры борьбы и профилактика
Мероприятия, направленные на уменьшение потерь от кокцидиозов, можно разделить на две большие группы. Одна группа методов имеет целью недопущение интенсивного заражения птиц экзогенными стадиями кокцидии - ооцистами, другая - направлена на борьбу с эндогенными стадиями, развивающимися в организме птиц.
Борьба с экзогенными стадиями кокцидии. В хозяйстве необходима охрана корма и питьевой воды от загрязнения пометом кур, уничтожение на территории возможных механических переносчиков ооцист (грызунов, насекомых и диких птиц): недопущение контакта цыплят с взрослыми курами, сырости в помещениях и на выгульных двориках. Перед посадкой птиц производится дезинвазия помещений, клеток, оборудования и предметов ухода от ооцист кокцидии. Ооцисты очень неустойчивы к высушиванию и высоким температурам, поэтому применение прокаливания, прожигания, просушивания, обработка горячим паром и водой является эффективным средством в дезинвазии внешней среды. Однако высокая температура и последующее быстрое охлаждение приводит к появлению трещин, в которых накапливаются как ооцисты, так и патогенная микрофлора. Выходом из сложившейся ситуации стала программа компании «РАБОС Инга.», в которой заложена четкая по-следовательность применения моющих и дезинфицирующих средств, что позволяет в короткие сроки получить положительный результат [6]. Кенококс - высокоэффективный дезинвазирующий препарат, предназначенный для уничтожения всех спорулированных и неспорулированных форм ооцист кокцидий в птицеводческих помещениях. Обладает пенными свойствами, быстро увлажняет все поверхности, нетоксичен и безвреден для птиц, поэтому его не нужно смывать [9].
Борьба с эндогенными стадиями кокцидий является наиболее эффективной и осно-вана на применении химических препаратов, тормозящих или полностью подавляющих их развитие. В зависимости от действия на стадии развития паразита антикокцидийные препараты подразделяются на препятствующие и не препятствующие выработке иммунитета. Иммунитет к кокцидиозу вырабатывается у птиц только при условии развития в их организме 2 и последующих генераций меронтов. Препараты, на фоне которых развивается небольшое число эндогенных стадий, ответственных за формирование иммунитета, не препятствуют формированию иммунитета. К таким препаратам относятся: ампролиум и его аналоги, кокцидиовит, клинакокс, байкокс, эйметерм, никарбазин, ста-тил [1,3].
Препараты, ингибирующие развитие 2 и последующие генерации меронтов, препятствуют формированию иммунитета. К таким препаратам относятся: койден, клопидол, фармкокцид, цикостат, ригекокцин, аватек, кокцисан, цигро, сакокс, монензин, салиновет, мадувет. Поэтому эта группа кокцидиостатиков рекомендована только для профилактики болезни при выращивании бройлеров весь период откорма и исключается из рациона за 3-5 дней до убоя.
Иммунопрофилактика кокцидиозов
Иммунитет при кокцидиозах нестерильный и непродолжительный - 50-60 дней. Это означает, во-первых, что в организме иммунных птиц развивается небольшое число кокцидий и, во-вторых, что иммунитет поддерживается постоянной незначительной реинвазией. Иммунопрофилактика кокцидиозов птиц перспективна в яичном и племенном птицеводстве. Подробнее о существующих вакцинах и методах их применения можно прочесть у В. А. Бакулина [1].
Список литературы
1. Бакунин, В. А. Болезни птиц / В. А. Бакулин. - СПб. : издатель В. А. Бакулин, 2006. - С. 364-374.
2. Бейер, Т. В. Протисты: Руководство по зоологии. Часть 2. Класс Coccidea Leuckart, 1879 - Кокцидий / Т. В. Бейер. - СПб. : Наука, 2007. - С. 216-229.
3. Енгашев, С. В. Эффективность препаратов-дженериков для профилактики и лечения кокцидиозов птиц /СВ. Енгашев, Д. Д. Новиков, А. 3. Журавлева // Вопросы нормативно-правового регулирования в ветеринарии. - 2012. - № 4/1. - С. 60-61.
4. Иллюстрированный Атлас болезней птиц. - Издательский дом Медол, 2009. - С. 163-165.
5. Кириллов, А. И. Кокцидиозы птиц / А. И. Кириллов. - М., 2008. - 230 с.
6. Краснобаев, Ю. Программа биобезопасности против кокцидиоза птицы / Ю. Краснобаев, А. Худяков // РацВетИнформ. - 2012. - № 3 (127). - С. 21-22.
7. Крылов, М. В. Возбудители протозойных болезней домашних животных и человека / М. В. Крылов. - СПб, ЗИН РАН, 1994. - Том I. - С. 161-165.
8. Крылов, М. В. Возбудители протозойных болезней домашних животных и человека / М. В. Крылов. - СПб, ЗИН РАН, 1994. - Том П. - С. 207-221.
9. Ташбулатов, А. А. Кенококс клинер - новый взгляд в решении проблемы кокцидиозов / А. А. Ташбулатов, Р. Т. Сафиуллин // Птицеводство. - 2011. - № 3. - С. 47-49.
10. Levine, N. D. Protozoan parasites on domestic animals and men/N. D. Levine. -Burgeness, Minneapolis, 1961.-P. 213.
11. Shirley, W. Studies to determine the taxonomic status of Eimeria mitis Tyzzer, 1929 and E. mivati Edgar and Seibold, 1964 / W. Shirley, T. K. Jefeers, P. L. Long // Parasitology.- 1983.-Vol. 87.-№2.-P.185-198.



