И.И. Кочиш, доктор сельскохозяйственных наук, С.Л. Смирнов, кандидат ветеринарных наук, Л.А. Волчкова, кандидат сельскохозяйственных наук,
Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина.
О.В. Соловьева АПК «Вихрово» (Вихрово, Московская область).
А.А. Ташбулатов , кандидат ветеринарных наук ООО РАБОС Интл» (Москва).
Сокращения: БГКП — бактерии группы кишечной палочки, ОМЧ— общее микробное число, ПДК — предельно допустимая концентрация
Введение
В промышленном кролиководстве одной из важных проблем является ветеринарно- санитарное состояние помещения и его воздушной среды. Воздух помещения содержит патогенные и условно-патогенные микроорганизмы, которые могут вызывать у кроликов различные заболевания [3]. В частности, отмечено наличие большого количества стафилококков, стрептококков, кишечной палочки и микозной микрофлоры. Степень микробной обсемененности зависит от условий содержания, микроклимата и других факторов внешней среды [2]. При этом существенных различий по степени обсемененности в летний и зимний периоды не обнаружено.
Высокая бактериальная обсемененность воздуха крольчатников, неудовлетворительные параметры микроклимата (сквозняки, резкие колебания температуры, высокая влажность воздуха, превышения ПДК по аммиаку, сероводороду) приводят к широкому распространению в хозяйствах в первую очередь болезней органов дыхания [1]. По данным ряда авторов, эти болезни наносят кролиководству значительный экономический ущерб [4, 5].
Неблагоприятные внешние факторы снижают общую сопротивляемость организма кроликов и создают условия для активизации условно-патогенной микрофлоры, которая постоянно содержится в носовой полости животных [2]. Микроорганизмы проникают через травмированную слизистую оболочку в организм кролика, где происходит их пассажирование, возбудители повышают свою патогенность и приобретают способность вызывать заболевание [2].
Данные литературы, анамнеза и патолого-анатомические изменения погибших от респираторных заболеваний кроликов (рис. 1) свидетельствуют не только о серьезности проблемы, но и сложностях поиска эффективных методов и средств профилакти-
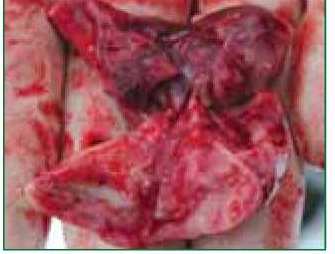
Рис. 1 Легкие кролика при пневмонии
ки заболевании органов дыхания. Одно из направлений профилактики — улучшение параметров микроклимата путем снижения бактериальной обсемененности в кролиководческих помещениях, чему следует уделять большое внимание.
Цель исследования
Изучить эффективность дезинфектанта (далее Дезинфектант) комплексного состава (глютаровый альдегид, четвертично-аммониевые соединения, спирт, терпентина дериват) в форме аэрозоля и целесообразность его применения в кролиководстве.
Материалы и методы
Исследования проводили в условиях кролиководческого хозяйства «Вихрово» Серпуховского района Московской области на кроликах калифорнийской породы разных половозрастных групп.
Благодаря инновационной формуле Дезинфектант способен эффективно работать в присутствии органических загрязнений в виде помета, пыли, грязи и т. д., ультрафиолетового излучения, низких температур в холодное время года и повышенной жесткости воды, характерной для большинства регионов России (до 400 мг/л солей кальция). Дезсредство можно применять в виде проливки, спрея, пены и аэрозольно. Кроме того, оно характеризуется высокой стабильностью рабочих растворов — до 7 суток. Дезинфектант эффективен и безопасен в применении, его рабочие растворы нейтральны и не обладают коррозионными и агрессивными свойствами, что многократно доказано опытным и практическим путем на сотнях ведущих сельскохозяйственных предприятий по производству и переработке продукции животноводства и растениеводства.
Средство по параметрам острой токсичности по ГОСТ 12.1.007. при введении в желудок относится к 3-му классу умеренно опасных веществ и к 4-му классу мало опасных веществ при нанесении на кожу.
Дезинфектант не приносит вреда экологии (распадается на 90 %).
Дезинфектант применяли в концентрации 0,35 % рабочего раствора, в дозе 5 мл/м3, методом холодного тумана с помощью генераторов. Крольчатник обрабатывали раствором Дезинфектанта двукратно с интервалом 7 суток. В рабочий раствор добавляли глицерин (до 10 % объема рабочего раствора) для лучшего распространения аэрозоля в воздушном бассейне помещения.
Проведено 2 серии опытов. В 1-й серии опытов определяли ОМЧ воздуха крольчатника в зимнее время: за сутки до 1-й обработки, через 25 мин, 3 суток, 7 суток после 1-й обработки или за сутки до 2-й обработки; через 25 мин, 3 суток, 7 суток после 2-й обработки.
Во второй серии опытов проводили микробиологические исследования воздуха в весеннее время, которое включало в себя определение числа БГКП; количества гемолитических и негемолитических стафилококков и стрептококков, наличие микроскопических грибов родов Aspergillus, Candida, Mucor. Микробиологические исследования проводили за сутки до 1-й обработки, через 25 мин, 3 суток, 7 суток после 1-й обработки или за сутки до 2-й обработки, и через 25 мин, 3 суток, 7 суток после 2-й обработки.
Результаты и обсуждение
Результаты исследований показали, что аэрозольная санация воздуха крольчатника способствует значительному уменьшению количества микрофлоры. После двукратной обработки Дезинфектантом в зимний период отмечено снижение ОМЧ в воздухе в 4 раза по сравнению с фоновыми показателями (нормативный показатель 50 тыс./м3).
ОМЧ составляла, тыс./м3, в 1-е сутки до обработки — 161, через 25 мин после обработки — 138; через 3 суток — 93; на 7-е сутки до обработки —71, через 25 мин после обработки — 63; через 10 суток после первой обработки — 52, через 14 суток после первой обработки — 40.
В весенний период состав микрофлоры воздуха был представлен следующими видами микроорганизмов, %: гемолитическими палочками (3,4), гемолитическими стафилококками (13,6), гемолитическими стрептококками (25), негемолитическими стрептококками (12,5), негемолитическими стафилококками (21,6), микрококками (5,7), бактериями группы кишечной палочки (15,9), грибами рода Mucor (2,3).
Через 25 мин после применения Дезинфектанта в воздухе животноводческого помещения было отмечено отсутствие гемолитических стрептококков, гемолитических палочек и микрококков, а также снижение содержания негемолитических стрептококков на 92,8 %, БГКП на 97,1 %, грибов рода Mucoi на 90 % по сравнению с фоновыми показателями микрофлоры воздуха крольчатника до обработки препаратом. На 34,7 % уменьшилось количество негемолитических стафилококков после обработки (рис. 2).
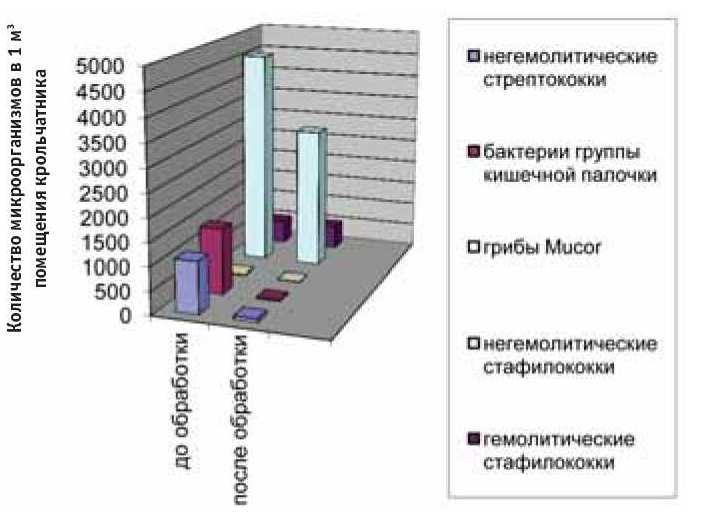
Рис. 2. Изменения микробного состава воздуха крольчатника после 25 минутной экспозиции Дезинфектанта
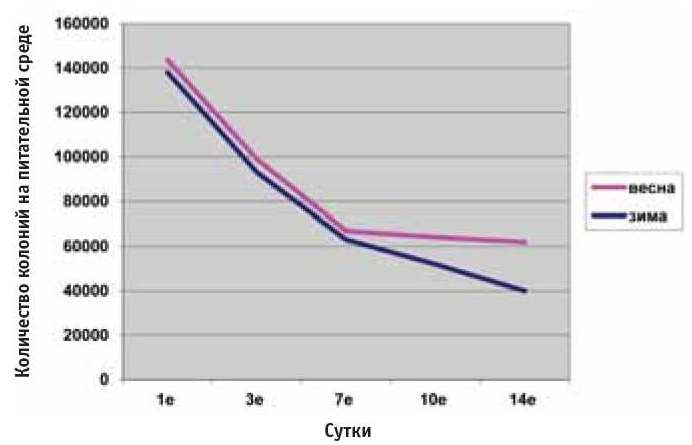
Рис. 3. Динамика ОМЧ воздуха крольчатника в зимне-весенний период
Установлено, что аэрозольная обработка способствует значительному уменьшению количества микрофлоры в воздухе помещения, при этом наилучший эффект достигается на 7-е сутки после повторной обработки Дезинфектантом, значительно снижается содержание в воздухе негемолитических и гемолитических микроорганизмов, кроме того, отмечен полное отсутствие БГКП и микроскопических грибов (см. рис. 2). Иными словами, создается длительный эффект от аэрозольной обработки Дезинфектантом воздушного бассейна крольчатника в присутствии животных.
При двукратном применении Дезинфектанта (холодный туман) как в зимний, так и в весенний период отмечено снижение ОМЧ воздуха в 4 раза на 7-е сутки после 2-й обработки (рис. 3).
Выводы
На основании полученных результатов можно рекомендовать использование 0,35%-го раствора Дезинфектанта, с интервалом 7 суток, в дозе 5мл/м3 и экспозицией 25 мин для аэрозольной обработки методом холодного тумана воздуха помещений в присутствии кроликов, что позволяет в несколько раз снизить бактериальную обсемененность воздуха крольчатника и уменьшить количество санитарно-показательных микроорганизмов.
Уменьшение содержания патогенной и условно-патогенной микрофлоры в воздухе крольчатника положительно сказывается на кроликах, у которых после применения Дезинфектанта снижается количество респираторных заболеваний на 60 %, увеличивается сохранность и прирост живой массы.
Таким образом, для создания оптимальных микроклиматических условий, снижения риска возникновения респираторных заболевании кроликов, при содержании в неблагоприятных в ветеринарно-санитарном отношении помещениях, целесообразно осуществлять аэрозольную дезинфекцию крольчатника 0,35%-м раствором Дезинфектанта — препарата комплексного состава (глютаровый альдегид, четвертично-аммониевые соединения, спирт, терпентина дериват) в дозе 5 мл/м3 методом холодного тумана в присутствии кроликов 1 раз в неделю, а длительность обработки препаратом определять исходя из санитарного состояния объекта.
Библиография
1. Вагин Е.А., Цветкова Р.П. Кролиководство в личных хозяйствах. — М.: Московский рабочий, 1991.
2. Рютова В.Г. Болезни кроликов. — М.: Россельхозиздат, 1985.
3. Старобровский А.А., Князев А.Ф. Влияние бактерицидного излучения на микроклимат в кролиководческих помещениях // Аграрный вестник Урала, 2010; 5:79-80.
4.Уткин Л.Г. Кролиководство. — М.: Агропромиздат, 1987.
5. Хабибулов М.А. Гигиена в промышленном кролиководстве. — М.: Росагропроиздат, 1989.
Российский ветеринарный журнал №2 2003