ОБОРУДОВАНИЕ И ИНСТРУМЕНТАРИЙ
Для работы необходимо иметь: сушильный шкаф, термостат, дистиллятор, бактерицидную камеру или ламинарный шкаф, стереоскопический бинокулярный микроскоп (МБС-9, МБС-10), шкаф для инструментов и посуды, одноразовые катетеры для извлечения эмбрионов, пластиковые пайеты (соломинки), зажимы, одноразовые шприцы на 20, 10,5,2 и 1 мл и инъекционные иглы, катетеры для пересадки эмбрионов (Рис. 4 и 5), пластиковые чашки Петри, пипетки, термометры спиртовые, термометры ртутные. Допускается использование катетеров для извлечения эмбрионов многоразового применения (Рис.3), а также стеклянной посуды (колбы на 2000 мл, часовые стекла и т.д.), выдерживающих длительную стерилизацию.
ПОДГОТОВКА КОБЫЛ-ДОНОРОВ И РЕЦИПИЕНТОВ К ПЕРЕСАДКАМ ЭМБРИОНОВ
С целью выявления признаков эструса проводят регулярную пробу кобыл (и доноров и реципиентов) жеребцом-пробником. Лучше проводить пробу ежедневно. При наличии дефицита обслуживающего персонала и большом опыте специалистов допустимо более редкое проведение пробы, но не реже трех раз в неделю (например, понедельник, среда, пятница). При выявлении охоты проводят ежедневную двукратную проверку состояния яичников ректальным методом.
При наличии в яичнике кобылы-донора фолликула третьей стадии (по Животкову, 1952) начинают ее случку или искусственное осеменение намеченным по подбору жеребцом-производителем. С целью повышения процента извлекаемости зародышей рекомендуем интервал между повторными случками, либо осеменениями свежей спермой, сократить до 24 часов, при искусственном осеменении криоконсервированным семенем - до 12 часов. Если для осеменения донора используется импортная замороженная сперма в соломинках, то этот интервал сокращается до 6 часов. При установлении факта овуляции осеменение кобылы-донора прекращают.
Одновременно с осеменением кобылы-донора проводят работы по синхронизации половых функций намечаемых кобыл-реципиентов с половыми циклами кобыл-доноров. Приживляемость трансплантатов наступает и при небольшой асинхронности момента овуляции у кобылы-донора и кобылы-реципиента в предшествующем пересадке половом цикле. Пересадки допустимы, если:
1) овуляция у кобылы-реципиента наступила раньше, чем у донора в пределах 24 часов (такую асинхронность половых циклов донора и реципиента обозначают +24 часа);
2) овуляция у кобылы-реципиента наступила позже, чем у донора в пределах 72 часов (-72 ч.).
Трансплантация зародышей при большей асинхронности сроков овуляции донора и реципиента нежелательна и ведет к пониженной приживляемости трансплантатов.
При наличии большого табуна кобыл-реципиентов, в котором можно легко подобрать животное с соответствующей степенью синхронности сроков овуляции, никаких вмешательств в протекание их половых функций не требуется. Если же имеющегося количества потенциальных кобыл-реципиентов недостаточно, то необходимо искусственно вызывать у них полноценную овуляцию в заданные сроки. Рекомендуем несколько схем обработки реципиентов с целью индукции овуляции в необходимые сроки. Основанием для выбора той или иной схемы обработки кобыл-реципиентов служит фактически установленная разница сроков овуляции у намечаемых кобыл - потенциальных доноров и реципиентов - в предшествующем пересадке эмбриона астральном цикле.
Схема 1. Если овуляция у кобылы-донора за цикл до пересадки наступила одновременно или чуть раньше (до трех суток), чем у потенциального реципиента, то в момент установления овуляции у донора кобыле-реципиенту следует ввести внутривенно 2000 ME человеческого хорионического гонадотропина. Овуляция у реципиента должна наступить через 36-48 часов после инъекции. Асинхронность донора и реципиента при этом составит -48 часов.
Схема 2. Если овуляция у кобылы-донора за цикл до пересадки наступила на 3-10 суток раньше, чем у реципиента, то в первый день проявления охоты кобылой-донором кобыле-реципиенту следует ввести внутримышечно простагландин F2a (название препаратов - Эстрофан, Энзапрост-Ф, Эструмат, Клопростенол, Динопрост, Просольвин, Клатрапростин и т.д.) в рекомендованных для кобыл дозировках (! Обращаем особое внимание на дозировки этих препаратов применительно к лошадям. Обычно дозы простагландинов для лошадей в 2-4 раза ниже, чем для крупного рогатого скота). Затем, в день наступления овуляции у кобылы-донора, кобыле-реципиенту вводят внутривенно 2000 ME человеческого хорионического гонадотропина.
Схема 3. Если за цикл до пересадки овуляция кобылы-реципиента наступила раньше, чем у кобылы-донора на 2-6 дней, то через 6 дней после овуляции у кобылы-донора обеим кобылам (и донору, и реципиенту) вводят внутримышечно простагландин F2a и через 5 суток - внутривенно 2000 ME человеческого хорионического гонадотропина.
В целях страховки от случайных факторов рекомендуем готовить на одного потенциального донора 2-3 потенциальных реципиента.
В случае, если донор осеменен правильно и своевременно и степень синхронности половых функций донора и реципиента находится в пределах от + 24 до -72 часов, задача по подготовке кобыл к пересадкам считается выполненной, и можно рассчитывать на положительный результат. Извлечение и пересадку зародышей производят через 8-8,5 суток после овуляции у кобылы-донора.
ПОДГОТОВКА ЛАБОРАТОРНОЙ ПОСУДЫ, ОБОРУДОВАНИЯ И ПОМЕЩЕНИЙ ДЛЯ ТРАНСПЛАНТАЦИИ ЭМБРИОНОВ
Работа по извлечению и пересадке эмбрионов требует строгого соблюдения мер асептики и санитарно-ветеринарных правил. Рекомендуется использование одноразовых инструментов и посуды.
Используемую лабораторную посуду, катетеры много-разового применения моют в растворе нейтрального моющего средства, затем ополаскивают проточной, дистиллированной и бидистиллированной водой. Стеклянную посуду (колбы, воронки, пипетки, чашки) высушивают, заворачивают в пергаментную бумагу и стерилизуют сухим жаром в течение 2-х часов при температуре 150°С или 3-х часов - при температуре 140°С.
В таком же режиме обеззараживают помещенный в стеклянную пробирку металлический катетер для пересадки эмбрионов, пипетки для переноса эмбрионов. Резиновый катетер для извлечения эмбрионов, шприцы и иглы кипятят в отдельных стерилизаторах в течение 40 минут, воду сливают, не открывая крышки, и охлаждают до комнатной температуры.
При наличии автоклава, все термически устойчивое оборудование, спецодежду и т.п. можно стерилизовать горячим паром в режиме 1,5 атм. в течение 30 минут.
Изделия из пластмассы, не выдерживающие тепловой стерилизации, моют, обеззараживают 70% этиловым спиртом, просушивают, выдерживают под УФ-облучением не менее 2 часов, упаковывают в стерильную бумагу и хранят в бактерицидной камере. Перед использованием инструментов в камере снова включают облучение на 2-3 часа.
Полиэтиленовые перчатки и чехлы одноразового пользования обрабатывают бактерицидными лампами в биокамере в течение 2 часов.
За сутки до намечаемой пересадки проводят влажную уборку и дезинфекцию помещений 3% раствором перекиси водорода (или «Глютекса»). Для приготовления дезинфицирующего раствора к 9 литрам воды добавляют 1 л 25-20% раствора перекиси и 50 г моющего средства. Для дезинфекции воздуха в помещении используют бактерицидные лампы, которые включают на 2-3 часа и выключают за 1 час до начала работ по трансплантации. При недостаточной мощности ультрафиолетового облучения (2 вт/м2) его продолжительность пропорционально увеличивают. В помещениях, где проводится работа с эмбрионами, должна поддерживаться температура 25-28°С и влажность воздуха 70-80%.
Приборы и лабораторные столы протирают ватными тампонами, смоченными в 70° спирте. Флаконы с фосфатно-буферной средой Дюльбекко также обрабатывают спиртовыми тампонами, пробку и горлышко обжигают пламенем горелки. Спецодежду операторов стерилизуют в сушильном шкафу или автоклаве в стандартном режиме.
ПРИГОТОВЛЕНИЕ РАСТВОРОВ
Для извлечения, непродолжительного хранения in vitro (вне организма) и пересадки эмбрионов лошадей применяют три раствора различного состава: 1. Промывной раствор применяют для извлечения и непродолжительного хранения (до 1 часа) эмбрионов in vitro. На промывание матки одной кобылы-донора обычно расходуют 2-2,5 литра этого раствора. Расход раствора зависит от величины животного, из расчета 0,5 литра на 100 кг живой массы донора. Учитывается также половой статус животного (у выжеребившихся или много рожавших кобыл размер матки может быть больше, чем у молодых кобыл). Для целей вымывания применяется фосфатно-солевой буферный раствор Дюльбекко (ФБС), выпускаемый отечественными (НПП «Панэко») и зарубежными («Minitube», Германия) фирмами. Правила хранения и срок годности раствора указаны на этикетке флаконов. Содержимое из стерильно откупоренных флаконов переливают в стеклянную колбу емкостью 2000 мл.
2. Ополаскивающий раствор используют для промывания матки кобылы-донора после извлечения эмбриона с целью подавления развития случайно занесенной в ее полость микрофлоры. Готовят 2 литра 0,9% раствора поваренной соли (NaCI) на основе дистиллированной воды. Двукратно доводят его до закипания (не давая кипеть), охлаждают до температуры 36-37°С и затем добавляют 20 мл 3%-ного раствора препарата «Полиген» (фирма «Мосагроген») из расчета 300 мкг/мл.
3. Пересадочный раствор представляет собой среду, обогащенную энергетическими источниками, поддерживающими эмбрион в жизнеспособном состоянии. Для этого используют ФБС Дюльбекко с добавлением 3-5% инактивированной фетальной сыворотки теленка или 5% бычьего сывороточного альбумина и антибиотиков (полиген в концентрации 300 мкг/мл). В этом растворе зародыши помещают в пересадочный инструмент и переносят в матку кобыл-реципиентов. Готовят раствор в заранее простерилизованном и закупоренном пенициллиновом флаконе. Для этого стерильным шприцем отбирают из флакона с ФБС Дюльбекко 10 мл раствора и закачивают в пенициллиновый флакон.
Туда же через стерильный шприц добавляют 0,3-0,5 мл инактивированной (предварительно выдержанной в течение 30 минут при 56-58°С на водяной бане) фетальной сыворотки теленка. Затем добавляют 0,1 мл полигена (величину рассчитать в соответствии с исходной дозировкой препарата). Ингредиенты осторожно перемешивают, не допуская образования пены. В такой среде эмбрион может находиться при температуре в период между вымыванием и пересадкой 37°С в пределах 30 минут.
Для более длительного хранения эмбриона рекомендуем применять культуральную среду, разработанную в лаборатории физиологии размножения лошадей ВНИИ коневодства (Лебедев С. Г., Лебедева Л.Ф. Авторское свидетельство N1497215 от 1.04.1989 г.). Она готовится следующим образом. Стерильным шприцем на 5 мл через иглу набирают 4 мл ФБС Дюльбекко и вводят, прокалывая пробку, в пенициллиновый флакон. Затем этим же шприцем засасывают 4 мл желтка куриного яйца категории «диетическое» и вводят в тот же флакон (для желтка удобнее пользоваться шприцем без иглы или толстой иглой). Полиген можно добавить отдельно (300 мкг/мл) или в составе ФБС Дюльбекко. Содержимое флакона (8 мл) тщательно перемешивают горизонтальными крутящими движениями, не допуская вспенивания. После перемешивания раствор готов к употреблению. В такой культуральной среде эмбрион при 37°С не только сохраняет жизнеспособность в течение, как минимум, 24 часов, но продолжает расти и развиваться. Однако, данный вариант пересадочного раствора подходит для эмбрионов диаметром >0,8 мм, поскольку он непрозрачный из-за высокого содержания желтка. Но эмбрионы в нем всплывают к поверхности и хорошо видны невооруженным глазом.
С целью поддержания оптимальной температуры все три приготовленных раствора помещают в термостат с температурой 37° С.
В последнее время зарубежные фирмыпоставщики («Minitube», Германия или «IMV», Франция) предлагают го товые среды для вымывания и эмбрионов лошадей в удобных упаковках, которые можно присоединять к промывному катетеру. В продаже имеются также готовые среды для краткосрочного хранения эмбрионов, расфасованные по 10-20 мл.
ИЗВЛЕЧЕНИЕ ЭМБРИОНОВ ИЗ МАТКИ КОБЫЛ-ДОНОРОВ
Эмбрионы с целью их последующей пересадки вымывают из матки кобыл-доноров через 8-8,5 суток после овуляции. Работы по извлечению зародышей необходимо проводить в следующей последовательности:
1. Кобылу-донора заводят в станок, фиксируют. Освобождают ее прямую кишку от каловых масс. Проводят туалет наружных половых органов и прилежащих к ним наружных покровов. Хвост бинтуют, либо помещают в специальный полиэтиленовый чехол одноразового пользования и привязывают к верхней перекладине станка.
2. Исполнитель одетой в обработанную УФ-облучением одноразовую полиэтиленовую перчатку рукой вынимает из стерилизатора катетер. Помощник через воронку ополаскивает его изнутри приготовленной промывной жидкостью. Исполнитель надевает на руку, сжимающую головную частью катетера, защитный полиэтиленовый чехол. Концевую часть чехла он забирает в горсть, закрывая катетер снаружи, и, придерживая пальцами руки, отрезает кончик чехла, обеспечивая в нем отверстие.
3. Исполнитель вводит руку с катетером во влагалище кобылы, разъединяет пальцы руки, расправляя чехол, и проталкивает головную часть инструмента через отверстие чехла в цервикальный канал, а затем в тело матки до тех пор, пока латексный баллон катетера не пройдет за шейку матки.
4. С целью фиксации инструмента в матке, помощник шприцем через специальный воздушный канал накачивает в раздуваемый баллон катетера 60 мл воздуха, запирая цервикальное отверстие изнутри, и перекрывает воздушный канал катетера зажимом. После этого катетер следует чуть потянуть наружу, чтобы баллон плотно прилегал к шейке матки.
5. Помощник через воронку заливает в катетер небольшое количество промывной жидкости. Затем катетер перекрывают, не допуская попадания в него воздуха. Помощник снимает воронку и опускает наружный конец инструмента в колбу с промывной жидкостью. Дальнейшее вливание раствора в матку и его обратное извлечение проводят путем поднятия и опускания колбы на 1-1,5 метра выше и ниже уровня половых органов кобылы. Перфузия матки происходит по принципу сообщающихся сосудов.
6. Проводят трехкратную перфузию матки промывным раствором. Затем двукратно промывают матку ополаскивающим раствором (см. раздел «Приготовление растворов»).
7. Спускают воздух из фиксирующего баллона и извлекают катетер из матки.
8. Колбы с использованными растворами переносят в специальное помещение или бактерицидную камеру для поиска и оценки эмбрионов (предварительно выключив УФ-облучение!).
9. Кобылу-донора освобождают и выводят из фиксационного станка.
ПОИСК, ОЦЕНКА И ЗАПРАВКА ЭМБРИОНОВ В ИНСТРУМЕНТ ДЛЯ ПЕРЕСАДКИ
8-8,5- суточные эмбрионы имеют достаточно крупные размеры (от 0,7 до 1,4 мм в диаметре) и хорошо видны в промывной жидкости невооруженным глазом. По внешнему виду они напоминают икринку рыбы или лягушки. Имеют шаровидную форму и полупрозрачны. Обычно 85% зародышей отыскиваются в промывной жидкости и редко (до 15%) - в ополаскивающем растворе. Найденные в ополаскивающем растворе эмбрионы также пригодны для пересадки, но время их пребывания в этом растворе должно быть максимально сокращено. Поэтому рекомендуем* осмотр колб с целью поиска зародышей начинать с ополаскивающего раствора, а затем - промывной жидкости. Как в ополаскивающем, так и в промывном растворе зародыши оседают на дно сосуда. В случае затруднения с поиском зародыша раствор в колбе посредством плавных круговых движений раскручивают, что приводит к взмучиванию осадка. Осевший зародыш при этом всплывает и, описывая круги, перемещается в толще жидкости и становится легко обнаруживаемым. Найденные эмбрионы отсасывают из колб посредством длинных стеклянных пипеток и переносят в чашки Петри с раствором ФБС для их оценки под бинокуляром. Для поиска мелких эмбрионов в промывной жидкости можно использовать специальные фильтры (например, конструкции НИИ Племенного животноводства, «Minitube», Германия или «IMV», Франция).
По внешнему виду, при осмотре под микроскопом, эмбрионы могут быть отнесены к одной из трех категорий: потенциально жизнеспособные, проблемные или сомнительные и погибшие.
Жизнеспособные эмбрионы имеют правильную форму (шаровидную или слегка эллипсоидную), полупрозрачны, имеют четко выраженную клеточную структуру и хорошо различимый зародышевый узелок (эмбриобласт). Эмбриональная оболочка (капсула) плотно прилегает к клеточной массе и при осмотре не видна (Рис.7).
Проблемные или сомнительные эмбрионы также полупрозрачны, шаровидной формы, имеют четкую клеточную структуру. Капсула у них бывает частично или полностью отслоена от клеток трофобласта и хорошо видна при осмотре зародыша под микроскопом (Рис. 8.). В наших опытах были случаи приживления и развития таких эмбрионов в нормальных жеребят-трансплантатов. Однако процент приживляемости зародышей этой категории понижен.
Погибшие эмбрионы непрозрачны, матового цвета, внешняя оболочка (капсула) сильно отделена от клеточной массы, клетки сморщены и сжаты в бесформенный комок (Рис.9). Пересадку таких эмбрионов не производят.
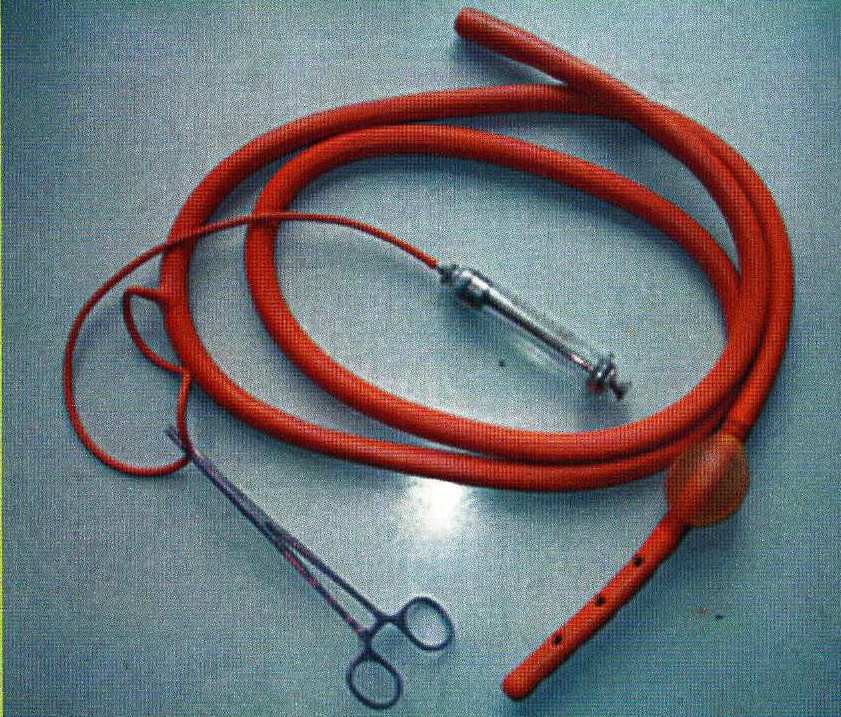
Рис.3. Катетер для извлечения эмбрионов

Рис.4. Катетер для пересадки мелких (до 0,8 мм в диаметре) эмбрионов в сборе

Рис.5. Катетер для пересадки мелких эмбрионов в разобранном виде с 0,5 мл соломинкой

Рис. 6. Пипетка для пересадки крупных (более 0,8 мм в диаметре) эмбрионов с внутренним пластиковым катетером (2 шт.) и наконечником для шприца
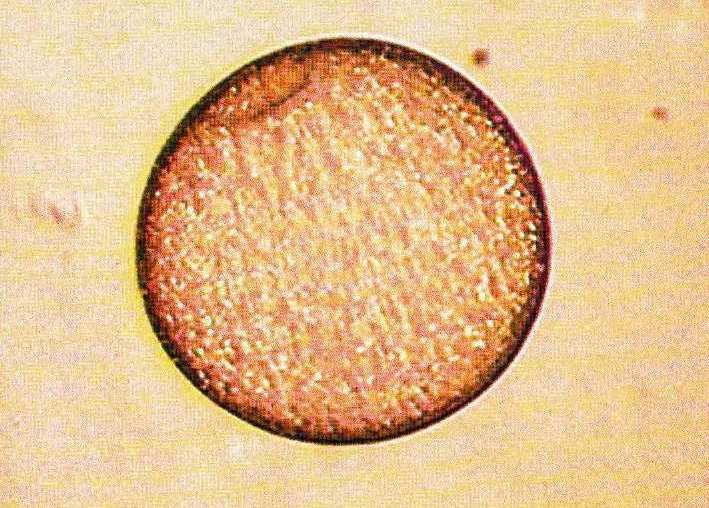
Рис. 7. Жизнеспособный 8-дневный эмбрион лошади
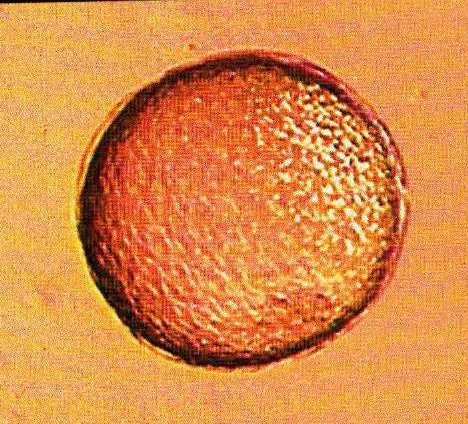
Рис.8 Сомнительный 8-дневный эмбрион лошади
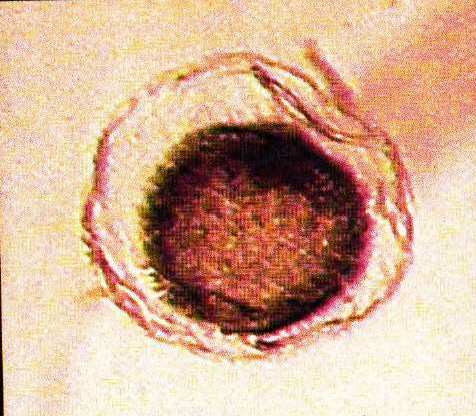
Рис. 9. Погибший 8-дневный эмбрион лошади
После оценки предназначенный для пересадки эмбрион стерильной пипеткой переносят из раствора ФБС в чашку Петри с пересадочным раствором. В целях удобства работы берут чашку Петри малого диаметра, пересадочный раствор наливают тонким слоем (2-3 мм) и помещают на столик микроскопа с нижней подсветкой. С помощью шприца (1-2 мл), через переходник, среду с зародышем, диаметр которого не превышает 07,-0,8 мм, засасывают в полиэтиленовую 0,5 соломинку (пайету) в следующей последовательности: 1/3 -1/4 длины пайеты - пересадочная среда, затем 5-7 мм - пузырек воздуха, затем 1/3-1/4 пайеты - среда с эмбрионом, затем снова пузырек воздуха, и оставшееся пространство заполняют средой. При соприкосновении с жидкостью клеевая пробка затвердевает, закупоривая конец пайеты.
Пайету отсоединяют от переходника и помещают в инструмент для пересадки открытым концом наружу, а клеевой пробкой - к стилету, навинчивают головку инструмента и на 2/3 его длины вставляют стилет. Поверх инструмента надевают полиэтиленовый санитарный чехол. Готовый к пересадке инструмент сохраняют в горизонтальном положении при температуре не ниже 18°С. Особенно тщательно следят за тем, чтобы вставленный на 2/3 длины стилет случайно не был продвинут глубже, что может привести к потере зародыша.
Для эмбрионов диаметром > 0,8 мм предусмотрены пересадочные пипетки с внутренним пластиковым катетером (например, фирмы Minitube, Германии), в который эмбрион с помощью шприца всасывается вместе с пересадочной средой в объеме 2 мл (Рис.6). В этом случае нет необходимости заправлять эмбрион в 0,5 мл соломинку перед пересадкой. Внутренний катетер плотно фиксируется в пипетке. При этом шприц остается соединенным с катетером до конца пересадки.
При работе с эмбрионами необходимо тщательно следить за температурой растворов и окружающей среды, резкие изменения которой как в одну, так и в другую сторону могут привести к повреждению и гибели трансплантата. Поэтому все манипуляции с зародышами следует проводить в помещении или камере с соблюдением требуемого температурного режима.
ПЕРЕСАДКА ЗАРОДЫША КОБЫЛЕ-РЕЦИПИЕНТУ
Пересадку зародыша кобыле-реципиенту выполняют в следующей последовательности:
1. Предварительно, для повышения уровня приживляемости эмбриона в матке кобылы, рекомендуется ввести реципиенту миорелаксант (препарат «Ханегиф», Венгрия, внутримышечно 8-10 мл) и, при необходимости, седативное средство.
2. Через 15-20 минут после инъекции кобылу-реципиента заводят в станок, фиксируют, освобождают от каловых масс ее прямую кишку, тщательно с мылом моют наружные половые органы и прилегающую к ним область, ополаскивают и высушивают бумажным полотенцем, бинтуют и фиксируют хвост в верхнем положении.
3. Одетой в одноразовую стерильную полиэтиленовую перчатку рукой берут приготовленный для пересадки инструмент с эмбрионом и сверху на его головную часть и руку надевают защитный полиэтиленовый чехол, как описано выше. Наружный чехол смазывают стерильным любрикантом (гелем-смазкой) для искусственного осеменения или УЗИ. Для металлического катетера с соломинкой внимательно проверяют положение отверстия для выхода эмбриона относительно прорези на наружной шайбе катетера, чтобы правильно сориентировать инструмент в матке кобылы (отверстием вниз).
4. Вводят руку с инструментом во влагалище кобылы.
Разъединяют верхний защитный чехол. Осторожно продвигают головную часть инструмента в цервикальный канал. Не касаясь стилета, прокалывают инструментом второй защитный санитарный чехол. Для пипетки с внутренним катетером следует воспользоваться помощью ассистента, который должен придерживать присоединенный к катетеру шприц, чтобы он не сорвался и жидкость с эмбрионом не вылилась раньше времени.
5. Вводят инструмент в тело матки кобылы-реципиента на глубину 2-5 см. Ориентируют инструмент по прорези шайбы так, чтобы его выходное отверстие в матке было направлено вниз, выталкивают содержимое пайеты, задвинув стилет в инструмент до конца. При использовании пипетки с внутренним катетером, присоединенным шприцем выдавливают его содержимое (2 мл среды с эмбрионом) в матку кобылы.
6. Извлекают руку с инструментом из влагалища. Освобождают и выводят кобылу из станка. После пересадки кобылу-реципиента желательно поводить 5-7 минут, прежде чем поставить в денник.
В дальнейшем кобыле-реципиенту рекомендован курс прогестиновой терапии (ежедневные внутримышечные инъекции по 4 мл 2,5% прогестерона в масле, либо прогестерона в оральной форме (Регумэйт, Альтреногест) с целью поддержания функции желтого тела для наступления и сохранения беременности. Обработку реципиента проводят, как минимум, до плацентации (45 дней жеребости).
ИНСТРУКЦИЯ ПО ИСКУССТВЕННОМУ ОСЕМЕНЕНИЮ И ТРАНСПЛАНТАЦИИ ЭМБРИОНОВ ЛОШАДЕЙ. - Дивово: Изд. ГНУ ВНИИ коневодства



