И.О. Переслегина
«Зооветком» (Реутов),
А.А. Виденина, А.Н. Наровлянский, А.В. Пронин, А.В. Санин
ФГБУ «Научно-исследовательский институт эпидемиологии и микробиологии имени Н.Ф. Гамалеи» МЗ РФ (Москва)
Сокращения: АлАТ — аланинаминотрансфераза, АсАТ — аспарташаминотрансфераза, АТФ — аде-нозинтрифосфат, в/в — внутривенно, в/м — внутримышечно, ГГТ— гамма-глутамилтранспептидаза, ГЛДГ — глутаматдегидрогеназа, ИЛ— интерлей-кин, ИФН— интерферон, ЛДГ — лактатдегидроге-наза, ME — международная единица, п/к — подкожно, ПЦР — полимеразная цепная реакция, СДГ — сор-битолдегидрогеназа, СОЭ — скорость оседания эритроцитов, УЗИ— ультразвуковое исследование, ЧСС — частота сердечных сокращений, ЩФ — щелочная фосфатаза, ЭКГ — электрокардиография, ЭОС — электрическая ось сердца, FIP — feline infec-tious peritonitis (кошачий инфекционный перитонит), fL — фемтолитр, PI — polyprenyl immunostimulant (иммуномодулятор на основе фосфорилированных полипренолов шелковицы)
Несмотря на значительный прогресс в ветеринарной медицине, FIP остается одним из самых загадочных, опасных и неизлечимых заболеваний. Ранее в редакционной статье [3] сообщалось о выступлении доктора Альфреда Лежандра на состоявшемся в 2011 г. 33-м ежегодном симпозиуме Winn Feline Foundation, посвященном проблеме лечения F1P. В докладе речь шла об особенностях и перспективах применения PI в качестве единственного средства этиотропной терапии сухой формы FIP. Всего PI применяли при лечении 102 кошек с сухой формой FIP, причем почти 20 % пациентов продолжают жить более года после начала лечения. У них отмечено улучшение общего состояния и качества жизни. В нашей стране также делались попытки терапии FIP при использовании в качестве зтио-тропных средств фосфорипированных полипренолов различного происхождения — фоспренила и гамап-рена [3, 4]. В настоящей статье описаны случаи лечения влажной формы FIP с использованием оригинальной комплексной методики, разработанной ветеринарным врачом И.О. Переслегиной.
Описание клинических случаев
Клинический случай № 1. Осенью 2011 г. на прием поступил пациент — кот Персик, возраст 1 год, порода русская голубая^ Жалобы владельцев: кота привезли с дачи, через две недели заметили, что он худеет. Поноса нет, аппетит сохранен. Были отмечены судороги, кот временами задыхается.
Клинические исследования. При пальпации установлено: живот увеличен, при подъеме за передние лапы жидкость переливается вниз, что придает животу грушевидную форму. Отмечена тахикардия (пульс 140... 152 уд/мин), тоны сердца жесткие, аритмия.
При ЭКГ определен эктопический нерегулярный ритм; ЧСС: среднее значение — 209 уд/мин, максимальное — 230 уд/мин, минимальное — 187 уд/мин; отклонение ЭОС влево, блокада левой ножки пучка Гиса, гипертрофия левого предсердия.
При УЗИ обнаружено: скопление в брюшной полости 35...45 мл жидкости, структура печени неоднородная, повышенной зернистости, эхогенность L = 82...85 (норма 65...68), печень выступает за край реберной дуги (увеличена). Края печени ровные, острые. Желчный пузырь в форме песочных часов (с перетяжкой в середине), умеренно наполнен, осадка в просвете нет/ Поджелудочная железа увеличена (в норме не удается визуализировать), уплотнена, структура нарушена. Почки без выраженных изменений. Мочевой пузырь наполнен, стенки тонкие, в просвете мелкие эхогенные образования, не отбрасывающие акустической тени.
Кровь из вены отдали на клинический и биохимический анализы (табл. 1). Выявлено резкое увеличение уровня глобулинов, драматическое снижение соотношения альбумин/глобулин на фоне умеренной анемии и гипербилирубинемии. Отмечено существенное повышение активности ферментов СДГ, ГЛДГ, АсАТ, АлАТ, ГГТ, ЛДГ и ЩФ. Кроме того, кровь и выпот-ную жидкость исследовали на FIP с помощью метода ПЦР (наличие коронавируса FIP подтвердилось в обоих случаях).
Поставлен предварительный диагноз — влажная форма ИР.
Терапия. Коту медленно промыли кишечник отваром ромашки, затем ввели per rectum 5 мл фоспренила (глубоко, на 8 см), подогретого до 40 °С. Через 2 ч процедуру повторили. Затем дали еще 3 мл теплого фоспренила per os и продолжали давать его каждые 2 ч в течение ночи.
На следующий день схема терапии была такова: вет-ранквил — 0,3 мл в/м, фоспренил — 1,5 мл в/м, гепт-рал — 1,5 мл в/м; АТФ — 0,4 мл (на растворе Ринге-ра) в/в, хлорид кальция — 0,5 мл |на физрастворе) в/в, тиосульфат натрия — 1,0 мл (на физрастворе) в/в, траумель — давали каждый час per os по 1,0 мл, фосфор гомаккорд 1,0 мл в/в; пумпан 5 капель 4 раза в день (в водном растворе) per os.
На 3-й день: ветранкви/т 0,3 мл в/м, панангин 0,8 мл в/в, рибоксин 1,0 мл в/в, АТФ 0,4 мл в/в, раствор Рин-гера 50,0 мл в/в. В брюшину ввели 20,0 мл физраствора (катетер расположили с левой стороны от белой линии, отступив 2...3 см от ребра), затем в течение 10... 15 мин кота аккуратно переворачивали с бока на бок и массировали ему живот. Откачанная жидкость была характерна для влажной формы ИР: соло-менного цвета, без запаха, достаточно вязкая, сильно
пенящаяся, слегка опалесцирующая, с белыми хлопьями; общий объем жидкости (учитывая введенный физраствор) — около 65 мл. Сразу после этого в брюшину с помощью 2 разных шприцов были введены теплые (40°С| растворы по 20 мл: фоспренил с физраствором (10:10) и диоксидин 0,5% с физраствором (10:10). В вену дополнительно инъецировали еще 2 мл трауме-ля. Поставили клизму с фоспренилом, дополнительно в/в ввели метронидазол, в/м бициллин-3, в/м гепт-рал, фуросемид 0,3 мл в/м. Траумель назначали 4 раза в день по 1,0 мл п/к.
После окончания манипуляций пациент чувствовал себя нормально, через 1 ч даже проявил некоторую активность (поиграл).
В течение двух следующих дней пациента лечили по схеме:
утро (все препараты давали в тех же дозировках, что накануне) — АТФ в/в, траумель п/к, ветранквил в/м, панангин в/в, рибоксин в/в, гептрал в/м, фосфор го-маккорд п/к, тиосульфат в/в, контрикал 5000 ед. в/в, пумпан 5 капель 3 раза в день, фоспренил 3,0 мл per os 3 раза в день, фоспренил в клизме после ромашки (теплый) 5,0 мл;
вечер — гамавит 2,0 мл в/в, траумель 1,0 мл п/к, гептрал 1,5 мл в/м, маннитол 10,0 мл в/в, фоспренил в клизме (теплый) 5,0 мл.
Состояние пациента было стабильным, аппетит сохранен, температура 39...39,3 °С.
На третий день в брюшной полости снова скопилась жидкость. Повторили процедуру с проколом брюшной полости. Объем асцита уменьшился до 40 мл вместе с физраствором. Манипуляции повторены.
В схему лечения добавили кардус и берберис (по 1,0 мл п/к). Судороги прекратились. Фосфор гомаккорд назначен 1 раз в три дня по 1,0 мл п/к. Живот уменьшился в объеме, при пальпации жидкость не выявлялась. Кот активно питался. Тиосульфат натрия отменен, доза маннитола снижена до 5,0 мл (очень активное мо-чеотделение).
К вечеру четвертого дня отмечено: жидкости в брюшной полости осталось всего около 20 мл по оценкам уЗИ. Ввели 10 мл физиологического раствора, вышло чуть больше 20 мл. Жидкость намного светлее, хлопьев нет. Пенилась намного меньше, вязкость также уменьшилась. Введен теплый фоспренил — 10 мл.
Терапия на следующей неделе включала в себя АТФ 0,4 мл в/в 7 дней; фоспренил 3,0 мл per os 3 раза в день; фоспренил 5,0 мл в клизме 1 раз в день (теплый); затем наринэ-форте (согрет в руке) 3,0 мл через 1 ч в клизме; рибоксин 1 мл 2 раза в день в/в; панангин 0,5 мл в/в 1 раз в день; фосфор гомаккорд 1,0 мл п/к 1 раз в день (3 дня,); мукоза композитум 1,0 мл п/к через день (2 недели); берберис 1,0 мл п/к 3 раза в неделю; хелидониум 1,0 мл п/к 3 раза в неделю; гамавит 1 мл п/к 2 раза в день (до 10 дней); пумпан 5 капель 3 раз в день 1 мес; бициллин 3600 тыс. ед.; конт-рикал 5 тыс. ед. на физрастворе (довести до 10 инъекций в/в); траумель по */г табл. 2 раза в день натощак.
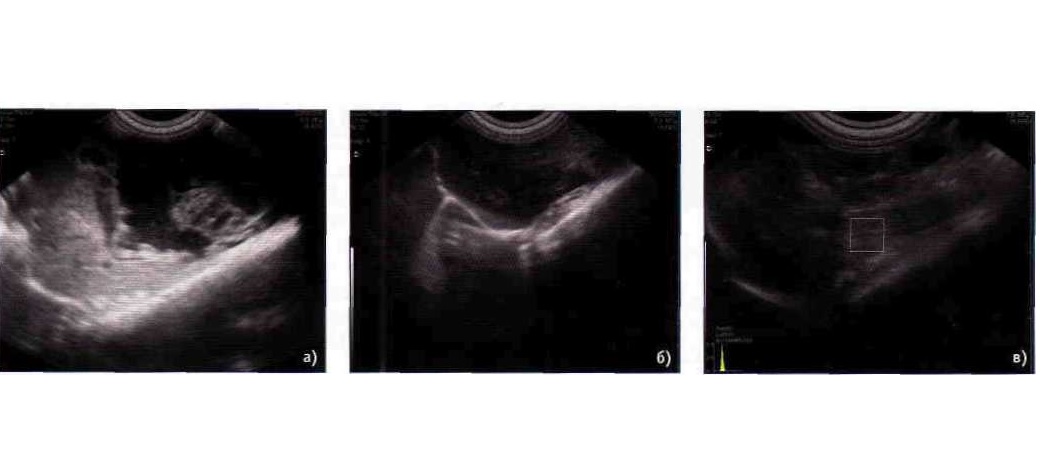
Рис. Сонограммы кошки Крыси:
а — на первом приеме 22.09.2008. В брюшной полости значительное количество жидкости;
б — на приеме 06.10.2008. В брюшной полости небольшое количество жидкости. Перистальтика кишечника сохранена;
в — на приеме 22.10.2008. Жидкости в брюшной полости практически не осталось
Через неделю сделаны повторные анализы крови (см. табл. 1): показатели, в том числе СОЭ, нормализовались, содержание гемоглобина увеличилось. Асцит -ная жидкость в брюшной полости отсутствовала, пациент чувствовал себя хорошо.
Данные на начало 2013 г.: кот активен и хорошо себя чувствует. Очередной анализ крови сделан 17.01.2013, то есть через 15 мес после постановки диагноза. Как видно из представленных в таблице 1 данных, практически все показатели находятся в пре-делах нормы.
Клинический случай № 2. В сентябре 2008 г. на прием поступила кошка Крыся, метис, возраст 6 мес. По данным анамнеза: кошку привезли из дома отдыха на Украине, где подобрали бездомной. Начала «пухнуть» через 2 недели после приезда в Москву. Владельцы наблюдали понос, который прошел после приема ветома. Пьет мало, играет, для дегельминтизации давали миль-бемакс.
Клинические исследования. При осмотре установлено: живот увеличен, круглый. Слизистые оболочки глаз бледные, в ротовой полости цианотичные, температура 39,4 "С, аппетит сохранен. При пальпации живота выявлена флюктуация.
Посредством уЗИ в брюшной полости обнаружено значительное количество жидкости (рис. а). Печень не выступает за край реберной дуги, уменьшена в размерах. Структура печени крупнозернистая с диффузной эхонеоднородностью. Эхогенность паренхимы печени L= 45...50.
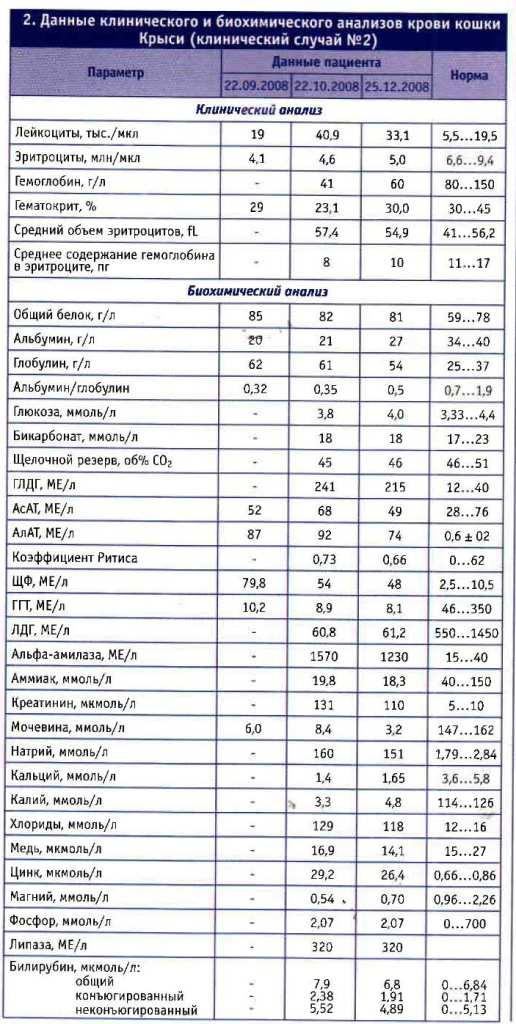
При клиническом анализе крови отмечены снижение гематокрита, умеренная анемия (табл. 2): при биохимическом анализе — повышение содержания общего белка, глобулина, мочевины, активности АсАТ, АлАТ, ЩФ, ГГТ, а также резкое снижение соотношения альбумин/глобулин. *
В сочетании с клиническими признаками, результаты УЗИ, анализов крови и выпотной жидкости послужили основанием для постановки, предварительного диагноза влажной формы FIP.
Терапия. Была назначена терапия, аналогичная той, что в описанном выше клиническом случае.
Повторный прием состоялся 6 октября 2008г. При УЗИ отмечены такие признаки: печень размером 7,5 см, незначительно выходит за край реберной дуги, однородной эхоструктуры, крупнозернистая, сосуды переполнены кровью. Контур ровный, острый. В брюшной полости небольшое количество жидкости (рис. б). Перистальтика кишечника сохранена.
22 октября по данным УЗИ жидкости в брюшной полости практически не осталось (рис. в).
25 декабря повторный прием — состояние пациента нормализовалось, визуально кошка клинически здорова. Взяты повторные анализы (см. табл. 2).
На 13 февраля 2013 г. пациентка жива, отлично выглядит, бодра и игрива.
Обсуждение
Экссудативный (влажный) перитонит — наиболее тяжелая клиническая форма FIP, которая обычно довольно быстро, в течение буквально нескольких недель, приводит к летальному исходу. В настоящей статье описаны два случая успешной терапии влажной формы FIR Диагноз ставили на основании дан-ных клинического осмотра, анализа перитонеально-го экссудата, а также результатов УЗИ, ПЦР, клинического и биохимического анализов крови, у обоих пациентов выявлен асцит с жидким экссудатом, характерным для влажной формы FIP: жидкость соломенного цвета, без запаха, достаточно вязкая, сильно пенящаяся, слегка опалесцирующая, с белыми хлопьями. При первичном анализе крови обнаружено резкое увеличение содержания глобулинов, а также драматическое снижение соотношения альбу-мин/глобулин на фоне умеренной анемии и гипер-билирубинемии. Кроме того, выявлено существенное повышение активности СДГ, ГЛДГ, АсАТ, АлАТ, ГГТ, ЛДГ и ЩФ. Повышенная концентрация глобулинов в плазме крови наряду со сниженным коэффициентом соотношения альбумин/глобулин служит одним из наиболее стабильно выявляющихся показателей при FIP [2, 5]. В сочетании с клиническими признаками, данными УЗИ, ПЦР, результатами анализа кро-ви и выпотной жидкости это послужило основанием для постановки предварительного диагноза влажной формы FIP.
После вынесения такого диагноза терапия традиционно направлена на снижение деструктивных воспалительных проявлений и облегчение состояния животного. Считается, что влажная форма FIP неизлечима и быстро ведет к смерти пациента.
К признакам ремиссии относят отсутствие или существенное снижение объема перитонеально-плев-ральной выпотной жидкости, исчезновение или значительное уменьшение клинических симптомов, снижение содержания глобулина, повышение соотно-шения альбумин/глобулин в крови, нормализация гематокрита и набор массы тела [5, 9].
В процессе терапии обоих пациентов с помощью оригинального подхода, разработанного ветврачом И.О. Переслегиной, удалось достаточно быстро и последовательно добиться достижения всех описанных выше показателей, свидетельствующих о наступлении ремиссии. С особым удовлетворением отмечаем, что оба пациента живы уже в течение более чем дли-
2. Данные клинического и биохимического анализов крови кошки Крыси (клинический случай №2)
тельного срока после установления диагноза влажной формы FIP — 15 мес и 52 мес, соответственно.
Описанная в настоящей статье комплексная методика терапии, хотя и довольно непроста, но полностью воспроизводима (в настоящий момент по этой методике вылечено и продолжает лечиться уже около десятка пациентов). При этом в качестве средства этиотропной терапии использованы предварительно подогретые фосфорилированные полипренолы. Отметим, что ветеринарные препараты на основе фосфорилированных полипренолов, выделенных либо из листьев шелковицы, либо из хвои, изучены в РФ довольно многосторонне. На их основе созданы и широко применяются в ветеринарной практике препараты гамапрен и фоспренил. Показано, что эти препараты обладают как иммуномодулирующим, так и противовирусным действием. Скорее всего, их терапевтический эффект при инфекционном коронавирусном перитоните проявляется комплексно. С одной стороны, эти препараты оказывают противовирусное действие при экспериментальной коронавирусной инфекции, вызванной, например, вирусом гепатита мышей. С другой стороны, после введения в организм при вирусной инфекции фоспренил и гамапрен активируют макрофаги и стимулируют раннюю продукцию ключевых цитокинов (ИЛ-12, ИФН-у), обеспечивающих формирование ТЫ иммунного ответа, которое нарушено при вирусном инфекционном процессе. Это представляется крайне важным с учетом данных о том, что развитие FIP у кошек после заражения коронавирусом напрямую связывают с отсутствием выработки ИЛ-12, необходимого для развития эффективного клеточного иммунного ответа [7]. Более того, при слабом клеточно-опосредованном иммунном ответе, когда наблюдается массовое размножение коронавирусов в макрофагах, заболевание переходит во влажную форму. Это позволяет предположить, что препараты на основе фосфорилированных полипренолов, активирующие макрофагальную активность, можно использовать не только для терапии, но и для профилактики влажной формы FIP. Это особенно важно, поскольку иные рекомендованные способы терапии FIP с использованием ИФН-омега, рекомбинантного кошачьего ИФН, глюкокортикоидов и циклофосфамида показали крайне низкую эффективность [6, 9]. Еще одним, хотя и косвенным свидетельством в пользу эффективности фосфорилированных полипренолов при FIP, служит тот факт, что для этого заболевания характерен феномен антителозависимого усиления вирусной инфекции [10].. Аналогичное явление характерно и для флавивирусных инфекций, при которых препараты на основе фосфорилированных полипренолов особенно эффективны [1]. .
Что касается данных о ремиссии, достигнутой у кошек при использовании PI, то они получены при терапии только сухой (неэкссудативной) формы FIP [8]. По мнению авторов, PI может рассматриваться как перспективное средство этиотропной терапии сухой формы FIP.
Библиография
1. Ожерелков СВ., Калинина Е.С, Кожевникова Т.Н., Санин А.В, Тимофеева Т.Ю., Тимофеев А.В., Стивенсон Д.Р. Экспериментальное исследование феномена антителозависимого усиления инфекционное™ вируса клещевого энцефалита in vitro // ЖМЭИ, 2008; 6:39—43.
2. Рахманина НА. Клинико-эпизоотологические особенности и диагностика инфекционного перитонита кошек: автореф. дисс.... канд. вет. наук. — М., 2007.
3. Санин А.В. FIP — виден ли свет в конце туннеля? // Российский ветеринарный журнал. Мелкие домашние и дикие животные, 2011; 4:17—20.
4. Фурман И.М., Васильев И.К., Наровлянский А.Н., Пронин А.В., Санин А.В, Применение препаратов на основе растительных полипренолов при различных формах кошачьего инфекционного перитонита // Российский ветеринарный журнал. Мелкие домашние и дикие животные, 2010; 3:42—43,
5. German A. Between a rock and a hard place: diagnosis and treatment of FIP//Abstr. ISFM Feline Symposium 2010, pre-BSAVA Congress.
6. Hartmann K, Ritz S. Treatment of cats with feline infectious peritonitis//Vet Immunol. ImmunopathoL, 2008; 15; 123(1-2): 172—175.
7. Kipar A., Meli Ml., Failing K,, Euler Т., Gomes-Keller M.A., Schwartz D., Lutz H., Reinacher M. Natural feline coronavirus infection: differences in cytokine patterns in association with the outcome of infection //Vet Immunol ImmunopathoL, 2006; 15; 112(3-4): 141—55
8. Legendre A.M., Bartges J.W. Effect of Polyprenyl Immunostimulant on the survival times of three cats with the dry form of feline infectious peritonitis// Feline Med Surg., 2009; 11(8): 624—626.
9. Pedersen N.C. A review of feline infectious peritonitis virus infection: 1963—2008 // Journal of Feline Medicine and Surgery, 2009; 11:225—258.
10. Takano Т., Katada Y., Moritoh S, Ogasawara M., Satoh K., Satoh R., Tanabe M., Hohdatsu T. Analysis of the mechanism of antibody-dependent enhancement of feline infectious peritonitis virus infection: aminopeptidase N is not important and a process of acidification of the endosome is necessary//J Gen Virol., 2008; 89(Pt4): 1025—1029.
Российский ветеринарный журнал. Мелкие домашние и дикие животные, №1 2013



