А. Г. ШАХОВ
ВНИВИПФиТ
Н.П. ЗУЕВ, В.Д. БУХАНОВ
БелГСХА
А.В. ЛОГАЧЕВ
Главный государственный ветеринарный инспектор Шебекинского района
Дизентерия свиней - контагиозная инфекционная болезнь, проявляющаяся кроваво-слизистой диареей и катарально-геморрагическим воспалением слизистой оболочки толстого отдела кишечника. Она протекает в виде эпизоотии и энзоотии, чаще ее регистрируют у поросят на участке доращивания и в первый период откорма независимо от сезона года. Источник возбудителя инфекции -больные и переболевшие свиньи, а природный резервуар - мыши и крысы.
Дизентерией чаще болеет 1 - 6-месячный молодняк. Инфекция может протекать остро, подостро и хронически. На ранней стадии болезни у свиней отмечают незначительное повышение температуры тела, затем потерю аппетита при сохранении жажды с быстрым истощением, эксикозом и гибелью животных.
Комплексную диагностику проводят на основании результатов эпизоотологических, клинических, патологоанатомических, микроскопических, бактериологических, люминесцентно-серологических и гистологических исследований. При дифференциальной диагностике исключают классическую чуму, трансмиссивный гастроэнтерит свиней, сальмонеллез, эшерихиоз, анаэробную дизентерию, балантидиоз, эймериоз, криптоспоридиоз и кормовые токсикозы. С переходом многих стран на промышленную технологию дизентерия свиней приобрела тенденцию к широкому распространению, нанося большой экономический ущерб.
Возбудитель болезни - Brachispira hyodysenteriae (1998) - грамотрицательная, подвижная (змееподобное движение), анаэробная спирохета с 2 - 3 (и более) плавными изгибами и заостренными концами, спор и капсул не образует, длина ее 6,0 - 11,0 мкм, диаметр 0,3 - 0,4 мкм. В. hyodysenteriae имеет внешнюю оболочку, а внутри клетки - 7 - 13 осевых фибрилл, входящих с каждого конца в цилиндр протоплазмы и перехлестывающихся вблизи центра спирохеты.
Культивируют В.hyodysenteriae на плотных селективных средах, содержащих триптиказосоевый (гороховый или слизистый из оболочки тонкого отдела кишечника свиней) агар, 10 % дефибринированной крови кролика, лошади, барана или крупного рогатого скота и 400 мкг/мл спектиномицина. Посевы инкубируют 48 ч при 42 °С в атмосфере, состоящей из 20 % СО2 и 80 % Н2. На кровяном агаре культуры В. hyodysenteriae вызывают выраженный (3-гемолиз эритроцитов, а на его поверхности образуют серовато-белый налет без выраженных колоний.
Оздоровительные мероприятия при дизентерии включают применение эффективных химиотерапевтических средств, проведение механической очистки, дезинфекции свинарников, подсобных помещений, предметов ухода, спецодежды и обуви обслуживающего персонала, дератизации и дезинсекции. В качестве лечебных и профилактических средств во многих странах, в том числе и в России,используют карбадокс, динамутилин, тиавет, диметридазол, ипронидазол, ронидазол, урзометронид, виргиниамицин, линкомицин, моненсин, салиномицин, седекамицин,тердекамицин (А.В. Голиков и соавт., 2001). Согласно инструкции (1978) в нашей стране применяют осарсол, ветдипасфен, нифулин, тилан, фармазин и трихопол.
В отечественной ветеринарной практике широко используют макролидные антибиотики из группы тилозина, чаще тилозин и фрадизин. Последний является одним из препаратов микробиологического синтеза, представляя собой кормовую форму тилозина. Выпускают фрадизин-5 и фрадизин-10, что свидетельствует о содержании в 1 г препарата 5 или 10 мг тилозина. Наряду с антибиотиком в его состав входит комплекс биологически активных веществ, в том числе аминокислоты, витамины, ферменты, макро- и микроэлементы (В.А. Антипов и соавт., 1982). В последнее время препарат выпускают в виде фрадизина-40 и фрадизина-50. При длительном применении эффективность их снижается.
Большинство зарубежных ученых чувствительность брахиспир к лечебным средствам определяют на плотных питательных средах, что усложняет и удорожает исследования. При этом точность получаемых результатов ниже, чем при использовании жидких и полужидких сред.
При разработке средств терапии больных дизентерией свиней многие исследователи, без определения чувствительности брахиспир к антибактериальным препаратам, эмпирически устанавливают их дозы и кратность применения. Такое положение объясняется трудностью выделения и культивирования брахиспир.
Цель исследований - определение чувствительности брахиспир к тилозинсо-держащим препаратам, а также бактерицидного действия фармазина и развития к нему устойчивости возбудителя, изучение некоторых особенностей фармакокинетики фармазина в организме поросят и его лечебной и профилактической эффективности при дизентерии свиней.
Материалы и методы. Чувствительность 4 штаммов брахиспир к антибиотикам из группы тилозина определяли методом 2-кратных серийных разведений, бактерицидную концентрацию фармазина и развитие к нему устойчивости этих штаммов изучали на полужидком 0,2 -0,25%-ном триптиказослизистом агаре (ПЖТСЛА), рН 7,0 - 7,2, содержащем 130 - 140 мг% аминного азота, 0,22 % хлористого натрия, 0,14 - 0,2% глюкозы и 0,05 % L-цистеина. Штаммы культивировали в микроанаэростате (МИ Модель 752) в присутствии алюмопалладиевого катализатора, состоящего из глинозема, покрытого измельченным палладием (2 % к глинозему). Воздух из камеры микроанаэростата откачивали вакуумнасосом и заполняли ее газом, содержащим 20 % углекислого газа и 80 % водорода. Микроанаэростат с посевами помещали на 72 ч в обычный термостат при 37 °С. Чувствительность брахиспир к исследуемым антибиотикам (тилану, тилозиноснованию, тилозину тартрата, фармазину, фрадизину) учитывали визуально по наличию или отсутствию роста микроорганизмов в питательной среде. Рост брахиспир в ПЖТСЛА характеризовался образованием беловатого диффузного облачка, расположенного в верхней части на границе соприкосновения с газовой средой. Концентрацию препарата в пробирке, в которой отсутствовал рост, суммировали с таковой в предыдущей пробирке, где отмечали рост культуры, и выводили средний показатель чувствительности испытуемого штамма к антибиотику.
Бактерицидную концентрацию фармазина определяли в 5 - 6 последних пробирках каждого ряда серийных разведений антибиотика с отсутствием роста брахиспир методом отмывания с помощью центрифугирования при 3500 - 4000 об/мин. После трехкратной отмывки бактерий от препарата в каждую пробирку, содержащую центрифугат, вносили по 5 мл ПЖТСЛА и культивировали 144 ч в анаэробных условиях. Среднюю бактерицидную концентрацию фармазина определяли так же, как и бактериостатическую.
Развитие устойчивости брахиспир к фармазину изучали in vitro при 10-кратном их пассировании на ПЖТСЛА с возрастающими концентрациями препарата. Каждый препарат и штамм исследовали до получения 3 сопоставимых результатов.
Фармакокинетику фармазина изучали на 24 здоровых поросятах со средней массой тела 11 - 12 кг, которых разделили на 2 группы (в первой было 9 животных, во второй - 15). Поросят первой группы дополнительно разбили на 3 подгруппы. Всем им вводили внутримышечно 1 раз в день в течение 3 сут 10%-ный водный раствор препарата: животным первой подгруппы в дозе 5 мг/кг, второй - 10 и третьей - 20 мг/кг массы тела. Дозу антибиотика рассчитывали по активно действующему веществу, то есть по тилозину. Поросятам второй группы препарат в течение указанного срока вводили в дозе 20 мг/кг. Спустя 3, 6, 12, 24 и 48 ч у животных первой группы исследовали сыворотку крови и фекалии. В эти же сроки проводили убой молодняка второй группы, беря у них пробы внутренних органов (печень, почки, селезенка, легкие, сердце, желудок, тонкий и толстый отделы кишечника), тканей (кожа, длиннейшая мышца спины) и содержимого ободочной кишки. Контролем служили сыворотка крови и экстракты тех же проб от животных, не получавших антибиотик. Содержание фармазина в пробах определяли на спектрофотометре СФ-26 по методике В.А. Антипова [3].
Лечебно-профилактическую эффективность фармазина изучали на 126 больных дизентерией и 309 контактировавших с ними поросятах. 10%-ный раствор препарата в дозе 20 мг/кг массы тела вводили молодняку внутримышечно 1 раз в день в течение 3 сут с лечебной целью и однократно - с профилактической. Одновременно станки, в которых находились больные или подозреваемые в заражении свиньи, 2 раза в сутки очищали от фекалий, а места испражнения животных посыпали негашеной известью. В начале и в конце лечения, а при однократной инъекции фармазина 2 дня подряд проводили дезинфекцию в присутствии животных 0,5%-ным раствором гидроокиси натрия и 0,5%-ным раствором формальдегида.
Полученные данные обрабатывали статистически общепринятыми вариационными методами.
Результаты исследований. Брахиспиры были чувствительны к тилану в концентрации 6,25±0,78 мкг/мл, а к тилозин-основанию, фрадизину, фармазину и тилозину тартрата - от 15,92±1,59 до 75,00±0,00 мкг/мл.
Чувствительность Brachispira hyodysenteriae к антибиотикам в наших опытах на ПЖТСЛА была выше в связи с тем, что K.Kitai et al. [8] проводили исследования на кровяном триптиказосоевом агаре, в котором эти препараты распределяются хуже, чем в полужидкой среде. Необходимо также учитывать, что присутствие углекислого газа в среде инкубирования снижает ее рН, поэтому антибактериальная активность макролидных препаратов уменьшается [9].
Полный терапевтический эффект фармазина у свиней со средней тяжестью течения болезни обеспечивала брахиспиростатическая концентрация его в толстом отделе кишечника (25,87 мкг/мл). В этом случае защитные механизмы организма больного животного способны освободить его от возбудителя дизентерии, подвергшегося воздействию антибиотика. Однако при остром течении, когда защитные реакции ослаблены, необходимо использовать препарат в дозах, обеспечивающих брахиспироцидный эффект. Минимальная бактерицидная концентрация фармазина для штаммов Ф1, Ф2, ФЗ и К1 возбудителя дизентерии составляла соответственно 40,33, 75,00, 33,45 и 33,45 мкг/мл.
Лекарственная устойчивость возникает в результате бессистемного применения малых доз препарата и от частого контакта возбудителя болезни с антибактериальным средством. 10-кратные пассажи культур брахиспир на ПЖТСЛА с возрастающими концентрациями фармазина показали медленное нарастание устойчивости. Так, через 5 пассажей его бактериостатическая концентрация повышалась в 2,9 раза (75,00±0,00 мкг/мл), а через 10 - в 17,4 раза (450,00±0,00 мкг/мл). Для сравнения брахиспиростатическая активность стрептомицина после 8 пассажей возрастала с 98,94±0,00 до 15000±0,00 мкг/мл и превышала начальную концентрацию в 151,6 раза.
После 3-кратного введения фармазина животным брахиспиростатическую концентрацию антибиотика в сыворотке крови не регистрировали ни в одной из подгрупп. Максимальное содержание препарата в сыворотке крови отмечали в течение 3 - 6 ч, но самым высоким оно было в первые 3 ч (7,26±0,3 - 14,75±3,82 мкг/мл). Незначительное содержание фармазина в сыворотке крови животных второй и третьей подгрупп наблюдали через 48 ч после его применения.
По данным И.Е.Мозгова (1985) терапевтическую концентрацию препаратов группы тилозина в крови регистрируют в течение 1,8 ч. Следовательно, в нашем опыте содержание фармазина в сыворотке крови с 1 по 3 ч могло быть более высоким, чем при исследовании через 3 ч после его введения.
Учитывая тропизм брахиспир к толстому отделу кишечника, мы изучили элиминацию фармазина с фекалиями. Наивысшее количество препарата выявили в первые 3 - 6 ч, оно превышало брахиспиростатическую концентрацию соответственно по подгруппам в 1,3; 2,3 и 5,6 раза. Брахиспироцидную концентрацию фармазина обнаружили только в испраж-
Таблица 1
Концентрация фармазина в сыворотке крови и фекалиях поросят после 3-кратного внутримышечного введения
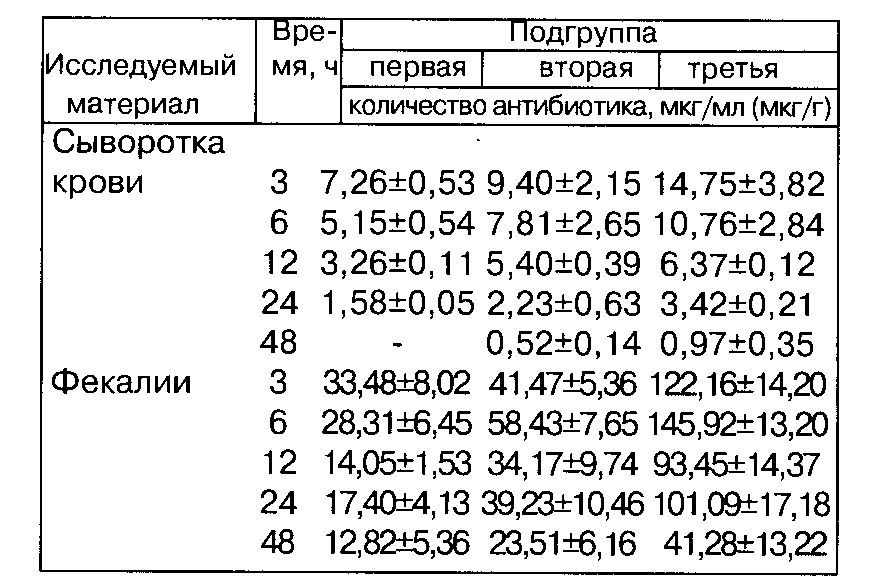
нениях молодняка второй и третьей подгрупп (табл. 1). При этом содержание препарата почти в 2 раза превышало установленную in vitro концентрацию, необходимую для преодоления развивающейся устойчивости брахиспир после 5-кратного пассирования на ПЖТСЛА. Повышенное содержание фармазина в фекалиях подопытных поросят через 24 ч свидетельствует о выведении препарата с желчью.
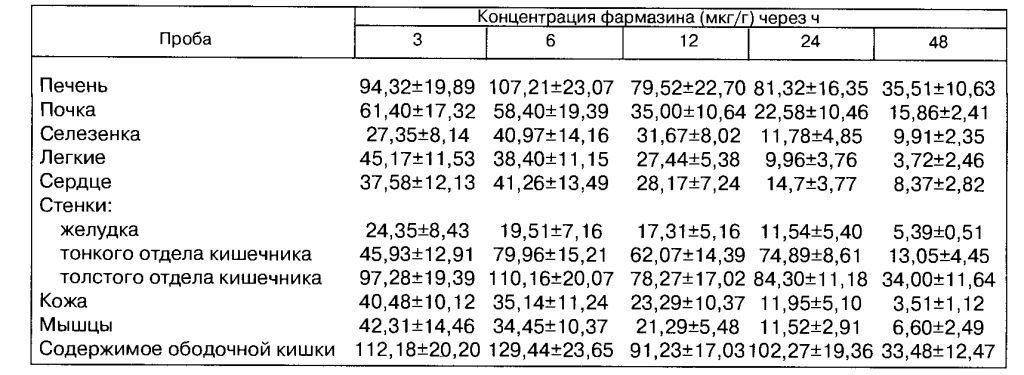
Согласно полученным данным поросятам с острым течением дизентерии 10%-ный водный раствор антибиотика целесообразно вводить внутримышечно 1 раз в день в течение 3 сут в дозе 20 мг/кг массы тела. Дополнительно для обоснования рекомендуемой схемы применения мы изучили распределение фармазина в органах и тканях животных после 3-кратного парентерального введения в дозе 20 мг/кг (табл. 2).
Наибольшее содержание препарата, которое значительно превышало брахиспироцидную концентрацию, регистрировали в печени, стенках тонкого и толстого отделов кишечника и в содержимом ободочной кишки в течение 3 - 24 ч. В последующие 24 ч уровень антибиотика в стенках тонкого отдела кишечника снижался, а в остальных пробах превышал брахиспиростатическую концентрацию, что свидетельствует об инактивации фармазина в печени и его выведении из организма с желчью.
Относительно высокая концентрация препарата в первые 3 - 6 ч в почках, по-видимому, связана с его частичным выведением из организма поросят с мочой. В селезенке, легких, сердце, коже и мышцах также регистрировали его повышенное содержание в течение 12 ч, а в стенке желудка на протяжении всего периода наблюдений оно было низким.
Фармазин достигал своей максимальной концентрации в органах и тканях поросят в первые 3 - 24 ч и выделялся с фекалиями более 48 ч. Поэтому убой свиней на мясо рекомендуем проводить не ранее чем через 6-7 сут после его 3-кратного внутримышечного введения в дозе 20 мг/кг массы тела.
Терапевтическую эффективность препарата изучали на 126 поросятах (85 - на доращивании и 41 - на откорме) в свиноводческих хозяйствах Белгородской области. Препарат в дозе 20 мг/кг вводи-
Таблица 2 Остаточные количества фармазина в органах и тканях поросят
ли внутримышечно у основания уха 1 раз в день в течение 3 сут. Место инъекции обрабатывали 70°-ным спиртом. На 2-й день лечения у поросят хотя и наблюдали жидкие или водянистые фекалии, но они не содержали примесей крови и в их ректальных пробах обнаруживали лишь единичные брахиспиры. У некоторых особей признаков болезни не регистрировали. На 3-й день наступало полное выздоровление: фекалии были оформленными, брахиспир в мазках не выявляли, аппетит восстанавливался. Во время опыта 2 поросенка с тяжело протекающим патологическим процессом пали из-за несвоевременной терапии. Спустя 3 недели после лечения рецидивов болезни не отмечали. Лечебная эффективность фармазина составила 98,4 %.
Контролем служили 22 больных поросенка, которым вводили метронидазол в дозе 10 мг/кг массы тела 1 раз в течение 3 сут. Клинические признаки болезни у них исчезли в течение 3 сут. Брахиспиры в мазках, приготовленных из ректальных проб, отсутствовали. Однако спустя 17 сут после лечения 4 поросенка повторно заболели дизентерией. Терапевтическая эффективность метронидазола составила 81,8%.
Профилактическую эффективность фармазина изучали на 309 поросятах, контактировавших с больными дизентерией животными. Им однократно инъецировали фармазин в дозе 20 мг/кг массы тела.
Животным идентичной группы (п=23) антибиотик не вводили, они служили контролем. После обработки поросят случаев заболевания дизентерией не регистрировали в течение 3 недель. В то же время в контрольной группе 26 % поросят заболело дизентерией. Эти данные свидетельствуют о выраженной профилактической и лечебной эффективности фармазина при дизентерии свиней.
Следует отметить, что при парентеральном способе введения препарата соблюдается точная его дозировка и быстро достигается терапевтический эффект. Дача фармазина пероральным путем нерациональна, так как больные дизентерией свиньи имеют пониженный аппетит, а в некоторых случаях даже плохо пьют воду. Прием лекарства через рот часто сопровождается у свиней рвотой.
Заключение. Поросятам с острым течением дизентерии 10 %-ный водный раствор фармазина целесообразно вводить в дозе 20 мг/кг массы тела внутримышечно 1 раз в день в течение 3 сут. Однократная инъекция фармазина в дозе 20 мг/кг массы тела свиньям, подозреваемым в заражении возбудителем дизентерии, профилактирует возникновение болезни.
ЛИТЕРАТУРА
1. Антипов В.А. и др. // Ветеринария. 1981. № 8.
2. Антипов В.А. и др. // Ветеринария. 1982. №1.
3. Антипов В.А. Научные труды ВНИИНБЖ. 1982.
4. Голиков А.В. и др. Химиотерапия дизентерии и инфекционных пневмоний свиней.- Белгород, 2001.
5. Инструкция о мероприятиях по борьбе с дизентерией свиней. Ветеринарное законо-дательство. 1981. Т. 3.
6. Мозгов И.Е. Фармакология.-М.:Агропромиздат, 1985.
7. Kielstein P. etal. // Monatshef-teFurVeterinar-Medizin. 1979. 34.9.
8. Kitai К. etal.//Anti-microb. Agents Chemoter. 1979. 15. 3.
9. Sutter V.L et al. //Antimicrob. Agents Chemoter. 1976. 10.
журнал "Ветеринария" №7 2007



