Продолжение. 1 часть здесь
Ультразвуковые исследования
При онкологических заболеваниях УЗИ дает весьма ценную информацию, т.к. позволяет выявить следующие патологические изменения:
— участки внутри структур из мягких тканей, наполненных жидкостью, т.е. области некроза и кровотечения;
— массы мягкой ткани внутри структур, наполненных жидкостью, например внутри мочевого пузыря или сердца;
— области аномальной ткани внутри органа, который обычно имеет однородную эхотекстуру (печень, селезенка, предстательная железа);
— крупные кровеносные сосуды внутри опухолевых масс.
1. УЗИ брюшной полости используют для диагностики изменений в печени, селезенке, почках, надпочечниках, мочевом пузыре, предстательной железе и других внутренних органах. Позволяет контролировать прицельную биопсию из тканей, подозреваемых в вовлечении в неопластический процесс, однако при проведении УЗИ важно помнить о комплексном подходе к постановке диагноза.
2. УЗИ грудной клетки позволяет диагностировать значительные опухоли легких, примыкающие к грудной стенке, опухоли сердца (с перикардиальным выпотом и без него) и средостения. Новообразования ребер с большим внутригрудным компонентом следует оценивать по их прикреплению к диафрагме, чтобы принять решение о соответствующем хирургическом вмешательстве.
Биопсия
Необходимая часть диагностики при любом онкологическом заболевании. Перед выбором ее метода нужно точно установить, что ожидается от патологоанатомического анализа тканей.

Рис 10. Объемное образование яичника
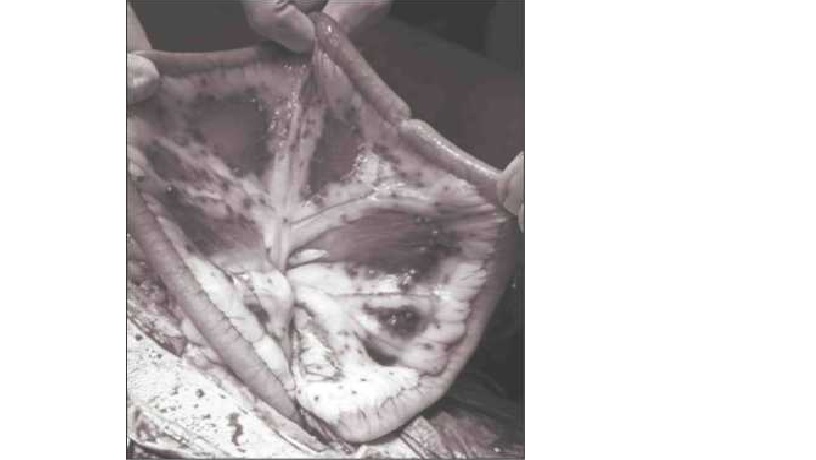
Рис. 11. Опухоль селезенки с метастазами в брюшную полость у таксы в возрасте 12 лет
Рис. 12. Хондросаркома у кота в возрасте 10 лет
С ее помощью можно:
— определить отдельные неопластические клетки;
— идентифицировать гистологические тип и градацию опухоли (степень злокачественности, вероятность метастазирования);
— оценить возможность хирургического иссечения.
Методы биопсии
1. Цитологические — анализ отдельных клеток или их групп, взятых с поверхности опухоли, из неопластических выпотов или путем пункции плотных новообразований. Основное назначение данного вида исследования — подтверждение факта неопластического заболевания, а в некоторых случаях — разделение на группы опухолей (например, отделение карцином от сарком). Выделяют:
— смывы жидкости и эксфолиативных клеток (промывание поверхности опухоли солевым раствором, сбор выпотов с помощью торакоцентеза, перитонеального дренирования, артроцентеза, спинномозговой и костномозговой пункций и т.д.);
— пункционные аспираты (с помощью подкожной иглы, шприца и предметного стекла);
— биопсию костного мозга (из гребня подвздошной кости, межвертлужной ямки бедренной кости, грудной кости);
— мазки-отпечатки (непосредственное прикладывание предметного стекла к поверхности опухоли).
Результаты данного исследования нельзя считать достаточным аргументом для точного диагноза, они не дают информацию об архитектонике, стромальной ткани и гистологическом типе опухоли.
2. Игловая биопсия применяется для получения небольших кусочков ткани из солидных опухолей и в случаях, когда образцы тканей значительных размеров нужны не только для идентификации неопластических клеток, но и для оценки архитектоники. Сопряжена с большим числом осложнений (кровотечением, отеком, дискомфортом) и необходимостью в общей анестезии.
Выделяют:
— биопсию иглами «Tra-Cut» со специальным приспособлением для захвата кусочка тканей (проводится под седацией);
— игловую биопсию костного мозга с использованием игл типа Джамшиди (длиннее и шире аспирационных игл) с зондом (мандреном).
3. Инцизионная биопсия — хирургическое удаление куска опухоли. Считается необходимым при инцизии большого количества ткани для определения типа опухоли и ее гистологической идентификации. Применима в случаях, когда новообразование расположено в недоступных для игловой биопсии местах. Требует общей анестезии, достаточно длительная процедура.
Выделяют:
— хирургическую эксцизию (биопсийный канал создают в том месте, где рубец от него возможно удалить вместе с опухолью при последующей хирургической операции, т.к. он потенциально будет загрязнен опухолевыми клетками; образец должен включать соседнюю нормальную ткань для сравнения и быть свободным от участков некроза);
— захват с поверхности (применяется для получения образцов со слизистых оболочек дыхательных путей, ЖКТ, мочевыводящих путей откусыванием специальным зажимом-кусачками).
4. Эксцизиониая биопсия — иссечение всей опухолевой массы с последующим отделением нужного образца для гистологического исследования. ТЬ
Методы лечения новообразований
1. Хирургическая операция;
2. Химиотерапия;
3. Лучевая терапия;
4. Воздействие гипертермией и криотерапией;
5. Комбинированное воздействие на опухолевый узел различными методами (операция + лучевая терапия);
6. Комплексное воздействие на опухолевый узел и отдаленные метастазы (лучевая терапия + операция + химиотерапия).
Оценка проведенного противоопухолевого лечения принята следующая:
— прогрессирование (увеличение опухоли более чем на 25%);
— стабилизация (уменьшение опухоли более чем на 25%);
— частичная регрессия (уменьшение опухоли более чем на 50%);
— полная регрессия;
— рецидив (рост опухоли на месте шва или раны);
— генерализация (выявление метастазов в жизненно важных органах).
Онкологическая хирургия
Для ветеринарного онколога она играет более важную роль, чем для медицинского, из-за ограниченных возможностей использования прочих методов лечения, например лучевой терапии.
Профилактическая хирургия
Направлена на снижение ожидаемого распространения опухолей определенного типа и частоты рецидивов после лечения. Примеры: стерилизация до первой течки, овариогистерэктомия (ОГЭ) при опухолях молочных желез (ОМЖ). Более 50% всех случаев ОМЖ являются эстрогензависимыми, т.е. их рост зависит от выработки указанных гормонов, поэтому при ОМЖ в некоторых случаях выполняют и ОГЭ. Другим примером являются доброкачественные опухоли влагалища у сук: стерилизация также предотвращает их развитие и рецидивирование, поэтому резекцию новообразования часто сочетают с ОГЭ.
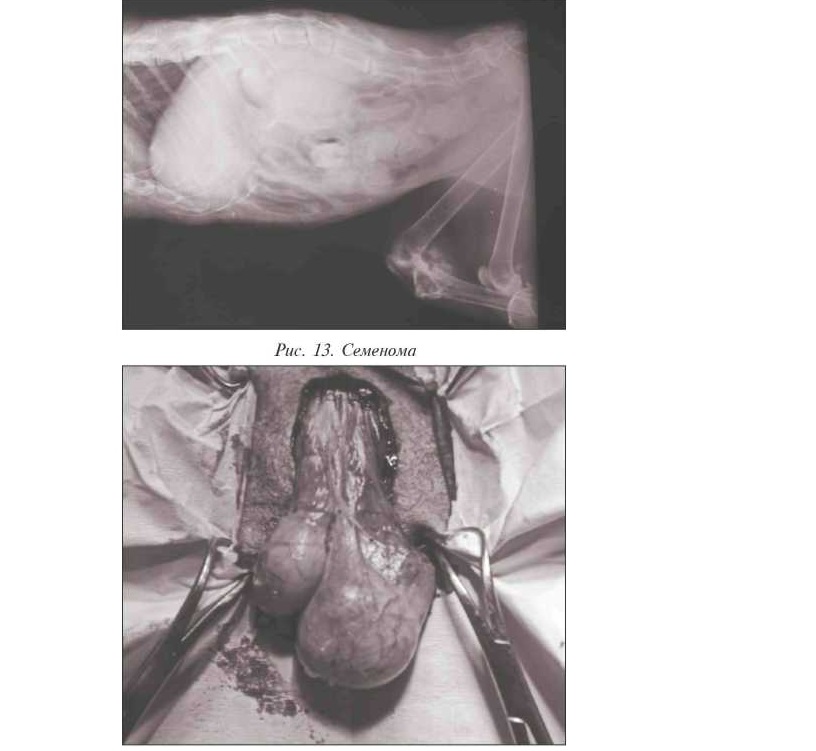
Еще одним примером являются новообразования семенников у кобелей: значительно чаще они развиваются в случаях неопущения в мошонку, поэтому кастрация, особенно у крипторхов, служит профилактикой развития этих новообразований.
Эксцизиозная хирургия (радикальная)
Данный хирургический метод остается основным даже в лечении опухолевых заболеваний человека. Однако существует ряд нозологии, при которых хирургическое лечение либо вовсе не применятся, либо носит вспомогательный характер (лейкозы, лимфосаркомы, трансмиссивная саркома собак, диффузные формы рака МЖ).
Метод теряет свои позиции за счет развития лучевой терапии и лекарственной терапии при остеосаркоме у собак, меланоме слизистых оболочек, раке кожи, многих круглоклеточных опухолях кожи. При доброкачественных опухолях операция остается практически единственным целесообразным методом лечения: достаточно ее удаления по видимой границе со здоровыми тканями, что должно привести к полному выздоровлению. При раках хирургическое лечение является достаточной мерой на первой и второй стадиях опухолевого процесса, на третьей — оно является компонентом комплексного лечения, на четвертой — нецелесообразно. При саркомах в подавляющем большинстве случаев оно является компонентом комбинированного или комплексного лечения, за исключением хондросаркомы, в лечении которой используют только его (без дополнительных лечебных процедур).
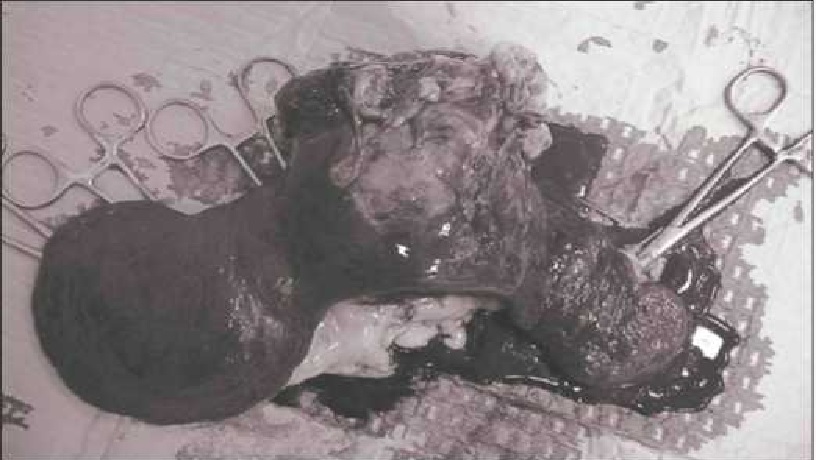
Рис. 14. Объемное образование селезенки
Радикальная онкологическая операция должна быть выполнена с соблюдением следующих важнейших принципов:
— принцип зональности предполагает удаление вместе с опухолью и окружающими ее здоровыми тканями еще и тканей, находящихся на пути регионарного лимфооттока. Как правило, это клетчатка, содержащая лимфатические сосуды и узлы первого-второго порядка. Например, рак 1-2 пары МЖ имеет регионарный лимфоотток в подмышечные лимфоузлы; у собак рак 4-5 пары молочных желез имеет лимфоотток в паховые лимфоузлы; третья пара МЖ имеет смешанный лимфоотток.
В связи с этим удалению подлежат:
• в первом случае 1-2-3 пары МЖ с подмышечной клетчаткой и лимфатическими узлами;
• во втором — 3-4-5 пары МЖ с паховой клетчаткой и лимфатическими узлами;
• в третьем — удаляют всю гряду МЖ и обе группы лимфатических узлов.
У кошек при наличии опухоли МЖ всегда выполняют унилатеральную мастэктомию с лимфаденэктомией;
— принцип блочности предполагает удаление новообразования в пределах выбранных хирургических границ единым блоком вместе с лимфатическими узлами и окружающей их клетчаткой;
— принцип футлярности предполагает удаление новообразования вместе со всем содержимым фасциального футляра, в котором оно находится. Он особенно важен при удалении сарком мягких тканей, которые распространяются вдоль фасций гораздо легче, чем поперек;
— важнейшим принципом проведения радикального хирургического лечения является абластика — комплекс приемов, направленных на недопущение рассеивания опухолевых клеток в процессе операции. Это прежде всего исключение грубых манипуляций с опухолью. Предпочительна острая препаровка тканей скальпелем или электроножом; избегают работы ножницами, тупферами. При удалении неоплазий, расположенных подкожно, следует по возможности удалять кожу, покрывающую опухоль, а вокруг линии разреза формировать кожные лоскуты. Это позволит произвести более широкое иссечение подкожных тканей и облегчит дальнейшее закрытие раны. Данное положение противоречит правилам общей хирургии, но вполне соответствует правилам хирургии онкологической.
Антибластика — мероприятия, препятствующие распространению и оставлению в ране жизнеспособных опухолевых клеток:
1. Послеоперационная лучевая терапия;
2. Лигирование магистральных сосудов до мобилизации опухоли;
3. Лигирование вначале вен, а затем артерий;
4. Использование электроножа для рассечения тканей;
5. Многократное мытье рук, смена перчаток, инструментов;
6. Промывание раны горячим (40°С) изотоническим раствором.
Принципы реконструкции раны
Удаление опухоли вместе с кожей и соседними тканями может приводить к образованию значительных дефектов. Для их реконструкции используют следующие приемы:
— заживление раны по первичному натяжению: небольшой дефицит кожи закрывают простым, или прямым, сопоставлением краев раны. В стратегических точках для снижения натяжения на линии шва накладывают подкожные «шагающие» швы. Разрез веретенообразной формы предотвращает образование складок лишней кожи и позволяет добиться косметического шва путем простого сопоставления краев кожи. Там, где удаление лишней кожи противопоказано, применяют многочисленные методы создания скользящих лоскутов кожи;
— заживление по вторичному натяжению — комбинация естественных процессов контрактуры и эпителизации без соединения краев кожи.
Эти методы в основном показаны для заживления загрязненных и травматических ран;
— закрытие раны лоскутом на ножке предполагает создание рядом с раной скользящего лоскута, который остается прикрепленным к коже с целью сохранения кровоснабжения;
— свободный кожный лоскут (в основном в дистальном отделе конечности) предполагает отбор кожи по всей толщине; применяют сетчатые и целые лоскуты, а также тонкие полоски шириной 0,5 см.
Паллиативная хирургия
Наши представления о злокачественных опухолях не оправдывают оставление без лечения животных в безнадежных случаях. Для таких ситуаций существует ряд сравнительно простых хирургических процедур, которые могут улучшить качество жизни пациента, несмотря на неблагоприятный прогноз. Паллиативная операция предполагает удаление новообразования в пределах кажущихся здоровыми тканей без полного удаления пораженного органа и окружающей его клетчатки с лимфатическими узлами. В этом случае операция предполагает не полное излечение пациента, а только уменьшение опухолевой массы и/или облегчение состояния пациента. Как правило, наряду с паллиативной операцией таким пациентам проводят дополнительные лечебные мероприятия.
Химиотерапия
Использование противораковых химиотерапевтических агентов при некоторых видах новообразований является единственным методом лечения (например, для системных лимфом). Эффект от применения противораковых химиотерапевтических препаратов напрямую зависит от правильности проведения данного вида лечения.
Цитотоксические средства убивают опухолевые клетки в соответствии с первым правилом химической кинетики — конкретная доза лекарства убивает определенный процент опухолевых клеток. Следовательно, их необходимо использовать в наивысшей возможной дозе, чтобы уничтожить как можно больше фракций клеток. Таким образом, целью химиотерапии является такое снижение количества опухолевых клеток, которое можно ликвидировать другими методами или контролировать, используя поддерживающую терапию.
Дозировку каждого химиотерапевтического препарата нужно выбирать так, чтобы он хорошо действовал на клетки опухоли и в то же время не оказывал существенного влияния на клетки хозяина. Дозу большинства цитотоксических агентов рассчитывают относительно площади поверхности тела, а не относительно веса. Было доказано, что кровоток через органы, которые
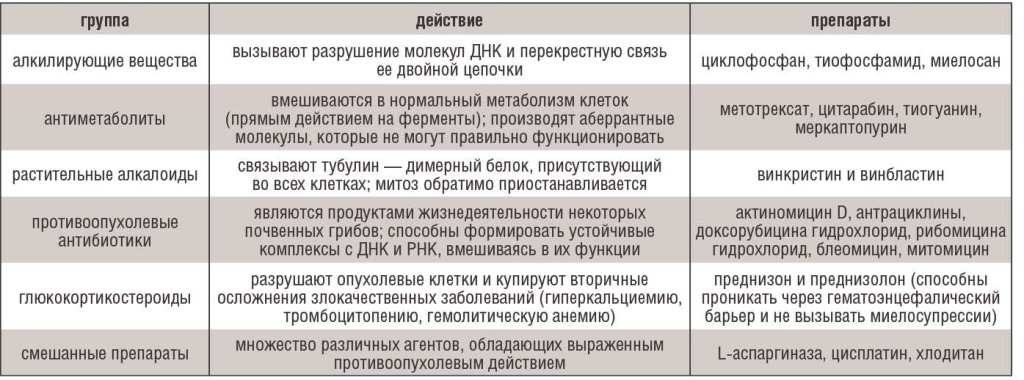
Таблица 2. Классификация химиотерапевтических препаратов
детоксицируют лекарства, особенно через почки и печень, зависит больше от площади поверхности тела. Эти расчеты позволяют не допустить передозировки у мелких собак и недостаточного введения — у крупных.
Интервал между курсами должен строго рассчитываться, чтобы одновременно было и уничтожено как можно большее число опухолевых клеток, и дано время на восстановление популяции клеток нормальных, особенно это касается тканей костного мозга и желудочно-кишечного тракта. Интервал не должен быть слишком большим, чтобы не дать распространиться остаточным опухолевым клеткам, что может привести к репопуляции массы, в которой, вероятно, будет больше клонов клеток, устойчивых к лекарствам. Если же он будет слишком коротким, нормальные клетки не успеют восстановить свою популяцию, а лекарственные средства проявят в последующем кумулятивное токсическое действие, что спровоцирует появление анемии, тромбоцитопении, нейтропении, рвоты и диареи.
В некоторых случаях химиотерапию проводят одним препаратом, но в основном препараты комбинируют (моно- и полихимиотерапия), тогда используют средства, поражающие клетки на разных стадиях деления, обладающие различным действием, не усиливающие токсичность и не мешающие действию друг друга.
Методы введения химиопрепаратов:
— внутривенно;
— внутриартериально;
— внутриплеврально;
— внутрибрюшинно;
— перорально;
— внутримышечно.
По способу введения химиотерапия может быть:
— локальной (в мелкие артерии);
— регионарной (в крупные артерии, например плечевую);
— системной (в вены, перорально и т.д.).
Различают:
— адъювантную химиотерапию (до оперативного вмешательства);
— неадьювантную химиотерапию (после операции).
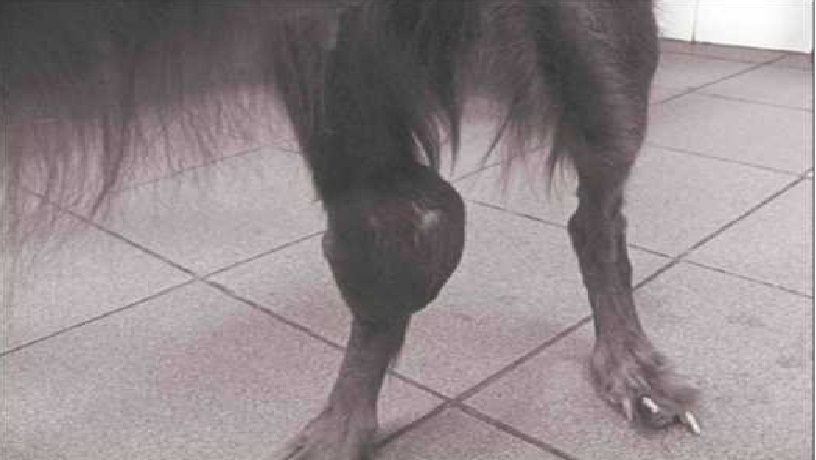
Рис. 15. Остеосаркома у ирландского сеттера в возрасте 13 лет
Осложнения химиотерапии
КЛИНИЦИСТ должен четко осознавать потенциальную токсичность химиотерапевтических агентов, особенно у животных с сопутствующими заболеваниями, и внимательно следить за ходом лечения.
Здесь выделяют:
— непосредственные побочные эффекты, которые наблюдают в течение 1 суток (анорексию, рвоту, флебит, аллергические реакции и синдром опухолевого лизиса — развитие ХПН в результате резкого, быстрого разрушения опухоли и выброса в кровь продуктов распада);
— ранние осложнения, проявляющиеся в первые дни и недели лечения (миелосупрессию, желудочно-кишечные и урологические осложнения, местные осложнения, некроз);
— отсроченные проблемы, которые наблюдают в течение недель и месяцев после начала лечения (кардиомиопатию, фиброз легких).
Существует множество причин безрезультатности химиотерапии. Это может быть и использование противораковых препаратов, предназначенных для других видов опухолей, и неправильные назначение и дозировка препарата, и нетолерантность пациента к побочным эффектам препарата. Главной причиной является развитие резистентности к препаратам у опухолевых клеток.
Лучевая терапия
Облучение — весьма действенный метод лечения рака, который все шире используется в ветеринарной медицине. Однако его применение затруднено, поскольку требует дорогостоящего оборудования и соответствующей подготовки персонала.
Принцип использования лучевой терапии при онкологических заболеваниях основан на том, что ионизирующее излучение убивает живые ткани. Оно является формой энергии, которая при поглощении биологическим материалом приводит к возбуждению и ионизации составляющих его атомов или молекул. Этот процесс может убить клетку, если затрагивает молекулы, крайне необходимые для ее жизни. Главной мишенью в основном является молекула ДНК, но в процесс отмирания клетки могут быть вовлечены и другие молекулы.
В настоящее время лучевую терапию и в медицине, и в ветеринарии назначают фракционно. Оптимальные соотношения времени и дозировки остаются предметами споров, поэтому в клинической практике разработка протоколов лучевой терапии происходит эмпирически. Чем выше разовая доза облучения (фракция), тем сильнее поражение нормальных тканей (особенно медленно пролиферирующих). Следовательно, предпочтительнее давать несколько малых доз облучения.
Источник излучения в основном кобальт- 60.
Экспозиционная доза = 1 Грей, суммарная доза = 40-60 Грей (суммарная поглощающая доза).
В ветеринарной онкологии лучевая терапия играет главную роль в лечении неоперабельных злокачественных опухолей (обычно новообразования ротовой, носовой полостей и конечностей). Важны не только тип, размер и объем неоплазии, но и клиническая стадия, наличие метастазов и сопутствующих заболеваний у пациента.
Часто лучевая терапия используется как дополнение к химиотерапии или хирургической операции (особенно паллиативной).
Облучение — очень сильное средство, способное вызвать тяжелые нарушения у пациентов. Острые реакции на облучение являются результатом отмирания быстро делящихся клеток кожи и слизистых оболочек (от покраснения до мокнущей десквамации). Поздние реакции возникают в медленно пролиферирующих тканях — соединительной ткани, костях (анкилоз и некроз суставов и мягких тканей).
Искусственная гипертермия
Было доказано, что злокачественные клетки разрушаются при температуре 42-45°С. Живые клетки разрушаются вследствие неселективной коагуляции и денатурации белков. В естественных условиях опухоли более подвержены влиянию тепла, чем нормальные ткани, которые лучше снабжаются кислородом и характеризуются более высоким показателем рН, что понижает их чувствительность к повышению температуры.
В клинической практике обычно проводят гипертермию при температуре 42-44°С в течение 30-60 минут.
Гипертермия может быть местной, региональной и всего тела. Хотя при ее применении возможна регрессия опухоли, это не дает ей преимущество перед другими методами лечения рака. Наибольшее клиническое значение гипертермия приобретает в соединении с облучением и химиотерапией, и в настоящее время такая комбинация чаще всего используется в клинической практике.
Криодеструкция
Самый физиологичный способ разрушения биологической ткани. Важно, что при ее осуществлении белки и нуклеиновые кислоты не денатурируют. Повреждение связано с иными механизмами и обусловлено в основном изменениями, происходящими с водой внутри и вне клетки.
При криодеструкции биологическая ткань превращается в лед. Кровообращение, поступление кислорода, питательных веществ, тканевое дыхание и все биохимические процессы на время замораживания полностью останавливаются. В результате гибнут клетки, в которых были длительно парализованы все процессы жизнедеятельности. Понижение температуры на границе патологической и здоровой ткани необходимо осуществлять в пределах, минимально необходимых для криогенного разрушения всего патологического очага. Эти значения колеблются в зависимости от видов тканей. Так, температура замерзания головного мозга составляет -20°С, а у кожи — -30°С. Однако, обеспечивая охлаждение на границе кожной опухоли до -20°С, осуществлять это с последующим оттаиванием необходимо не менее 3 раз. Много-кратное замораживание-оттаивание позволяет снизить летальную для патологической ткани температуру, найти своеобразный компромисс между стремлением как можно сильнее заморозить этот очаг и необходимостью сохранить здоровыми окружающие ткани.
Основное преимущество криохирургии в онкологии состоит в том, что она абсолютно абластична, злокачественные клетки при ее правильном осуществлении и, разумеется, после него просто не могут распространяться с током крови, лимфы и по межтканевым промежуткам.
Демаркационная линия возникает быстро, поэтому интоксикация и температурная реакция, даже после разрушения весьма больших объемов и площадей патологической ткани, отсутствуют. Это позволяет рекомендовать одномоментное разрушение сверхнизкими температурами сразу большого числа патологических образований единой или разнородной природы.
Отсутствие общих отрицательных реакций организма на криодеструкцию позволяет осуществить ее одномоментно, затрагивая в большинстве случаев сразу все образования на коже и доступных слизистых оболочках у одного пациента. Процедура не сопровождается торможением кроветворения
2007 • НОЯБРЬ • ВЕТЕРИНАРНЫЙ ДОКТОР



