Нарусбаева М. А., Бокарев А. В., Стеколышков А. А.
ФГБОУ ВО «Санкт-Петербургская государственная академия ветеринарной медицины» Адрес: 196084, Россия, Санкт-Петербург, Черниговская ул., д. 5
Введение
Остеохондродеструктивные заболевания тазобедренного сустава являются актуаль-ной проблемой как гуманной, так и ветеринарной медицины. Этиологические факторы данной группы болезней весьма разнообразны. В том числе имеют место наследственные и идиопатические факторы. Несмотря на различие в причинах заболеваний данного типа, их патоморфологические процессы в большинстве случаев сходны и заключаются в том, что процесс ремоделирования костной ткани смещается в сторону резорбции и некроза, а восстановление костной ткани при этом не достигает компенсаторного уровня. Поскольку априори имеет место и остеопатия, и разрушение субхондральной кости, ухудшается трофика суставного хряща. И впоследствии происходят его дистрофические изменения вплоть до полного разрушения [1, 3, 8].
Очевидно, что при критическом разрушении сустава единственным способом восстановления локомоторной функции конечности является резекция головки бедра с последующим протезированием [8, 11].
Но на более ранних стадиях предпринимаются различные способы укрепления шейки и головки бедра. Например, хирургическим армированием, ксеногенными и биогенны-миимплантами [1, 2, 8, 11]. А также исследуется возможность восстановить структуру сустава ближе к физиологической введением донорских костных и/или хрящевых клеток [2, 3, 8] или клеток, которые в научной литературе называют мезенхимные стволовые [4-7, 9, 10].
Априори понятно, что армирование ме-таллом позволяет сразу (т.е. уже в процессе операции) усилить прочность сустава. Однако также понятно, что данная процедура позволяет укрепить сустав только на время, так как металл не обладает остеоиндуктивными свойствами и, соответственно, не остановит разрушение костной ткани. Более того, имеют место клинические случаи, когда вокруг металлического импланта образуется зона усиленного некроза, что провоцирует «асептическую нестабильность» [1, 8, 11].
Терапия стволовыми клетками если и приведёт к восстановлению прочности сустава, то не сразу, а через довольно длительное время.
Можно предположить, что в качестве ма-териала для армирования можно было бы использовать аутологичную трубчатую кость подходящего диаметра, и в этом случае достигался бы двойной эффект: во-первых, прочная трубчатая кость выполняла бы роль арматуры и, во-вторых, живые аутологичные клетки донорской кости стали бы источником остеогенеза.
Однако, анализ данных научной литера-туры показывает, что на пути практической реализации данной идеи могут возникнуть проблемы. Т.е. аутогенный трансплантат, представленный только компактной костной тканью, действительно обладает регидностью и силой, и поэтому теоретически может обеспечить быструю и сильную структурную поддержку в реципиентной зоне. Но, как следует из научных публикаций, он подвергается «медленному замещению» [2, 3, 8], т.е. рассасывается после операции и, вероятно, не может являться источником клеток с высоким пролиферативным потенциалом для восстановления костной ткани головки/шейки бедра.
В то же время, аутогенный трансплантат, представленный только губчатой костной тканью, хоть и не рассасывается после опе-рации и является источником жизнеспособ-ных остеобластов [8], однако, в силу своей пористой структуры, не может сразу после имплантации оказать реальную структурную поддержку в реципиентной зоне.
В качестве компромисса можно было бы использовать компактно-губчатые трансплантаты, но в настоящее время подобные трансплантаты используются в основном в качестве заплатки на участки реципиентной кости после удаления её части. Причем такие заплатки представляют собой фрагменты, в которых одна сторона является губчатой костью, а противоположная - компактной, и закрытие костного дефекта в реципиентной зоне осуществляется так, что губчатая ткань трансплантата контактирует с губчатой тканью реципиентной кости, соответственно, компактная ткань трансплантата контактирует с компактной тканью реципиентной кости.
Таким образом, данные о том, как может себя повести трансплантат, представленный аутогенной цельной трубчатой костью с хрящом, после имплантации в шейку/головку бедра (и, тем более, в шейку/головку бедра, находящихся в состоянии деструкции) в настоящее время отсутствуют.
Цель исследования - выяснить возможность использования цельных аутогенных костно-хрящевых трансплантатов для армирования тазобедренных суставов, ослабленных остеодеструктивными процессами.
Задачи исследования: 1 - пересадить аутологичный костно-хрящевой трансплантат в область патологически измененных проксимальных шейки/головки бедренной кости; 2 - провести рентгенологический мониторинг прооперированного сустава в разные сроки после операции с тем, чтобы визуализировать изменения трансплантата в условиях костного окружения шейки/головки бедренной кости.
Материалы и методы
Объектом исследования послужили пять собак породы йоркширский терьер с диагностированной односторонней болезнью Легга-Кальве-Пертеса. Операцию проводи-ли по собственной методике. Техника опе-рации в настоящий момент находится в стадии оформления авторского свидетельства. В процессе операции у животного изымали фрагмент трубчатой кости с хрящом и подсаживали продольно в шейку/головку больного сустава. Рентгенологический мониторинг проводили на рентгеновском аппарате РО60 на протяжении нескольких месяцев после операции.
Результаты исследования
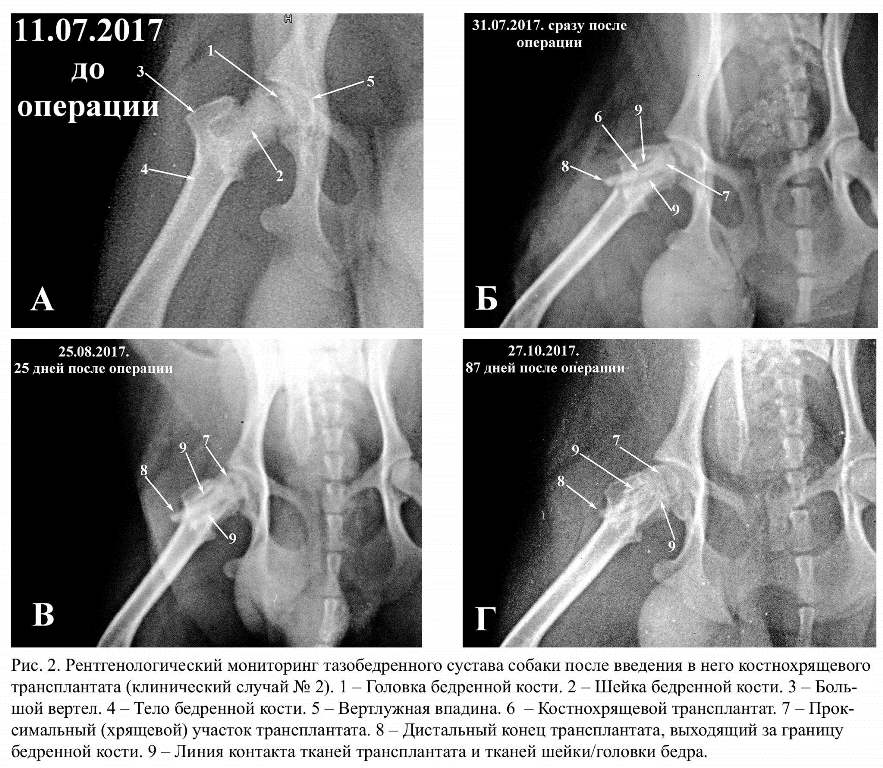
Данные рентгенологических исследований, сделанных до операции, показывают, что у всех животных, использованных в эксперименте, в области тазобедренного сустава выявлены признаки остеохондроде-струкции (рис. 1 А, рис. 2 А), на основании которых можно поставить диагноз «болезнь Легга-Кальве-Пертеса».
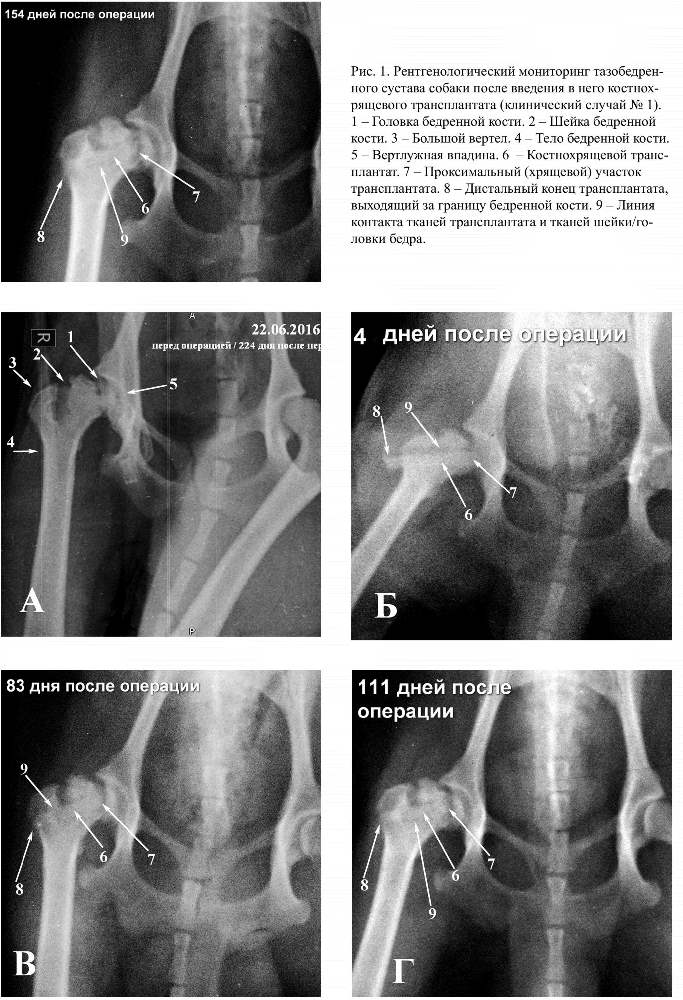
Снимки, сделанные непосредственно по-сле завершения операции, визуализируют рентгеноконтрасный объект, локализующийся по центральной продольной линии всей шейки и головки бедра (рис. 2 Б-6). С двух сторон объекта визуализируются четкие линии пониженной рентгенографической плотности (рис. 2 Б-9).
Снимки, сделанные через 3-5 дней после операции, визуализируют рентгенографическую картину, сходную с той, которая имела место на снимках, сделанных непосредственно после операции (рис. 1 Б-6; 9).
Рентгенограммы, сделанные в период от 14-ти до 30-ти дней после операции, визуализируют постепенное повышение рентгенографической плотности линий, отграничивающих трансплантат от собственной кости шейки/головки бедра, вследствие чего эта линия становится менее отчётливой (рис. 2 В-9). Кроме этого, практически на всех рентгенограммах визуализируется увеличение размера, но без видимого уменьшения рентгенографической плотности проксимального отдела костнохрящевого трансплантата, который исходно локализуется в области собственного проксимального эпифиза бедренной кости (рис. 2 В-7). Также заметно уменьшение рентгенографической плотно-сти той части дистального отдела трансплантата, которая на первых постоперационных рентгенограммах визуализируется как эктопический участок повышенной рентгенографической плотности, располагающийся за пределами латеральной границы бедренной кости (рис. 2 В-8).
Дальнейшее мониторирование послеопе-рационных изменений, проводимое в период с 30-го по 90-й день, показывает, что линии пониженной рентгенографической плотности, исходно выделяющие трансплантат на фоне собственно кости шейки/головки тазобедренного сустава, практически пере-стают визуализироваться в области головки и становятся очень слабовыраженными в области шейки (рис 1 В-9, рис. 2 Г-9). А в части случаев зона контакта с реципиентной костью имеет даже повышенную рентгенографическую плотность.
Рентгенограммы, выполненные через 150 дней после операции, демонстрируют практически полное отсутствие визуализации линий раздела между трансплантатом и реципиентной костью (рис. 1 Д-9). При этом общая рентгенографическая плотность шейки и головки бедра не понижается и, наоборот, даже повышается (рис. 1 Д) в сравнении с рентгенографической картиной, выполнен-ной до проведения операции (рис. 1 А).
Обсуждение результатов
Одним из способов укрепления головки и шейки бедра при деструктивных болезнях сустава является армирование, которое выполняется при помощи металлических вин-тов из специальных сплавов. Однако данная процедура не индуцирует регенеративных процессов в суставе. Регенеративные процессы могут быть стимулированы аутогенным костным трансплантатом, применяемым в виде утрамбованной костной стружки. Но трансплантат в виде стружки не обладает свойствами арматуры.
Очевидно, что отличными армирующими свойствами должна обладать трубчатая кость. А если данная кость является аутогенной, то её клетки могут служить источником остеогистогенеза, а её костные морфогенетические протеины могут служить стимулятором остеоиндукции.
Однако данные о том, как может повести себя трансплантат из цельной трубчатой ко-сти, имплантированный непосредственно внутрь шейки/головки бедра, на настоящий момент отсутствуют.
И, более того, имеются данные, что использование цельного аутотрансплантата (в отличие от утрамбованной костной стружки) для замещения костных дефектов из-за недостаточно плотного контакта с костью способствует тому, что на многие ме-сяцы остаются участки склерозированной кости и незамещенных пустот, видимых на рентгенограмме. Всё это не способствует образованию однородной структуры кости, стимулируя образование кист. И вместо армирования, наоборот, создает большую опасность возникновения переломов на месте операции [1-3].
Наши собственные исследования показали, что, действительно, сразу после операции и некоторое время после неё хорошо визуализируются линии пониженной рент-генографической плотности между трансплантатом и собственной костью сустава, что свидетельствует о неплотности их кон-такта после имплантации (рис. 1 Б-9, 2 Б-9).
Однако уже с 14-го дня после операции рентгенографическая плотность в зоне кон-такта трансплантата с собственно костью шейки/головки бедра начинает повышаться (рис. 1 В-9, 2 В-9). А рентгенографическая плотность эктопического дистального конца трансплантата, выходящая за границу бедренной кости, понижается (рис 1 В-8, 2 В-8). Первое является свидетельством того, что идёт процесс остеогистогенеза по периферии трансплантата. А второе - что имеет место процесс остеолизиса в том месте трансплантата, где он не контактирует с бедренной костью.
Кроме того, следует отметить увеличение в размерах проксимального отдела трансплантата, который представлен хрящевой тканью (рис. 2 В-7). Подобные изменения в размерах хрящевой части трансплантата можно интерпретировать как гипертрофические и/или гиперпластические перестройки хрящевых клеток трансплантата при их контакте с субхондральной костью и хрящевой тканью проксимальной головки бедренной кости.
Описанные выше изменения ещё более отчётливо визуализируются в период, близ-кий к 90-100 дню после операции. Т.е. граница контакта трансплантата с собственной тканью бедренной кости практически перестаёт визуализироваться в области головки и становится слабовыраженной в области шейки (рис. 1 Г, 2 Г). А в части случаев зона контакта имеет даже повышенную рентгенографическую плотность.
Рентгенограммы, выполненные через 150 дней после операции, демонстрируют практически полное слияние трансплантата и собственной ткани бедренной кости как в области шейки, так и в области головки (рис. 1 Д). И поскольку при этом общая рентгенографическая плотность шейки и головки бедра не понижается (а в части случаев даже повышается), логично предположить, что имплантированный трансплантат, не подвергаясь тотальной резорбции, укрепляет костные ткани шейки/головки бедренной кости. Причем, поскольку на протяжении всего мониторинга не отмечены рентгенографические признаки прогрессирования остеохондродеструкции, можно считать, что данное укрепление обусловлено не только пассивным армированием, но и активной стимуляцией остео- и хондросинтетических процессов.
Вся перечисленная динамика соотноше-ний тканей трансплантата и кости шейки/ головки бедра в разные послеоперационные сроки ещё более отчётливо прослеживается на артефактном клиническом материале, при котором трансплантат был введен нечётко по середине продольной оси шейки, а с некоторым латеральным смещением (рис. 3 Б-6). При этом граница контакта трансплантата и реципиентной кости была только одна (рис. 3 Б-9) и визуализировалась более отчетливо за счёт того, что зону контакта не экранировали собственные костные ткани шейки/головки бедра, лежащие над и под трансплантатом. Тем не менее, и в этом случае сохраняется вся та же закономерность, описанная выше. Т.е. через 14 дней после имплантации можно наблюдать постепенное уменьшение зоны, разделяющей кость трансплантата и кость шейки бедра (рис. 3 В-9).
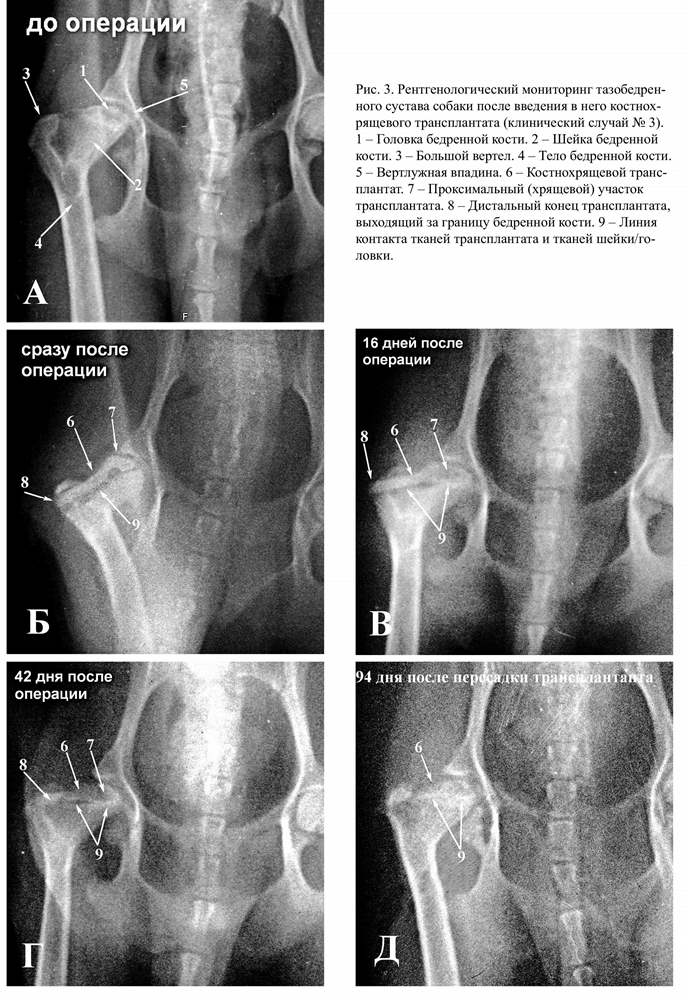
Проксимальная часть трансплантата, представленная эпифизарной костью и хрящом, увеличивается в размерах и изменяет форму, становясь более конгруэнтной отно-сительно суставной впадины (рис. 3 В-7). Через 30 дней после имплантации участки разделения кости трансплантата и кости шейки визуализируются лишь фрагментарно (рис. 3 Г-9). А через 90 дней после имплантации граница между костью трансплантата и костью шейки/головки бедра визуализируется уже не как зона пониженной рентгенографической плотности, а наоборот как линия повышенной рентгенографической плотности (рис. 3 Г-9), что свидетельствует о том, что в зоне контакта кости трансплантата и кости шейки/головки бедра отсутствуют незамещенные пустоты, но могут быть очаги послеоперационного склероза.
Следует отметить, что сходные рентгенографические признаки начального и окончательного слияния кости трансплантата и собственной кости шейки/головки бедра у разных пациентов несколько варьируют по срокам. Ретроспективный анализ дооперационных рентгенограмм пациентов даёт основание полагать, что скорость при-живления трансплантата может зависеть от стадии остеохондродеструкции. Т.е. чем выраженнее признаки остеохондродеструкции в суставе до операции, тем медленнее может идти процесс приживления трансплантата.
Заключение
Таким образом, на основании рентгено-логических исследований мы можем заключить, что:
1 - цельный костнохрящевой трансплантат, введённый в шейку/головку тазобедренного сустава, не рассасывается полностью и армирует ткани, ослабленные дистрофическими болезнями;
2 - цельный костнохрящевой трансплантат, введённый в шейку/головку тазобедренного сустава, стимулирует процессы обновления и укрепления костной ткани и подавляет процессы остеодеструкции;
3 - хрящевые клетки костнохрящевого трансплантата замещают дефицит собственного хряща проксимальной головки тазобедренной кости.
Список литературы
1. Волков Е.Е., Кэцинь Хуан. Асептический некроз головки бедренной кости. Безоперационное лечение: пер. с китайского. М., 2010. 128 с.
2. Волков М.В., Бизер В.А. Гомотрансплантация костной ткани у детей. М.: Медицина, 1969. 219 с.
3. Волков М.В. Болезни костей у детей: 2-е изд. М.: Медицина, 1985. 512 с.
4. Первый опыт применения комбинированного клеточного трансплантата на основе мультипотентных стромальных клеток (МСК) из жировой ткани у пациентов с выраженным дефицитом костной ткани в области верхней и нижней челюстей / И.С. Алексеева, А.В. Волков, А.А. Кулаков и др. // Матер. Всероссийск. науч. школы-конф. для молодежи. М., 2009. С. 53.
5. Регенерация костей черепа после трансплантации тканеинженерной конструкции на основе аутологичных мультипотентных стромальных клеток, преддифференцированных в остеогенном направлении.
Аутологичные стволовые клетки: экспериментальные и клинические исследования / А.В. Волков, С.А. ТТТустров, И.С. Алексеева и др. // Матер. Всероссийск. науч. школы-конф. для молодежи. М., 2009. С. 51.
6. Регенерация костной ткани после трансплантации аутологичных мезенхимных стромальных клеток/ В.Е. Мамонов, Н.В. Сац и др. // Матер. Всероссийск. науч. школы-конф. для молодежи. М., 2009. С. 62.
7. Регенерация трубчатой кости при введении суспензии ММСК. Аутологичные стволовые клетки: экспериментальные и клинические исследования / Л.Б. Буравкова, А.С. Капланский, Е.Р. Андреева и др. // Матер. Всероссийск. науч. школы-конф. для молодежи. М., 2009. С. 14.
8. Хемиш Р. Дени., Баттервоф Стивен Дж. Ортопедия собак и кошек. М.: Аквариум, 2004. 696 с.
9. Bone regeneration and stem cells / К. Arvidson, B.M. Abdallah, L.A. Applegate et al. // J. Cell. Mol. Med. 2011. V. 15., N4. P. 718-746.
10. Cranial reconstruction using autologous bone marrow stromal cells / Mahesh Mankani, Sergey Kuznetsov et al. // Canine American Journal of Pathology. 2006. V. 168, N 2. P. 542-550.
11. Griffon Dominique J. Evaluation of osteoproductive biomaterials: allograft, bone induc-ing agent, bioactive glass, and ceramics. Helsinki, 2002. 100 p.