Аксенова П. В., Айбазов М. М., Коваленко Д. В.
ГНУ «Ставропольский научно-исследовательский институт животноводства и кормопроизводства»
Введение
Технология трансплантации эмбрионов складывается из ряда последовательных операций, каждая из которых является самостоятельной законченной методикой. Первая из них - это подбор доноров и индукция у них полиовуляции.
Теоретические принципы вызывания множественной овуляции были разработаны в 1934 г. М. М. Завадовским [7], который применял этот способ с целью повышения плодовитости овец. Исследования получили продолжение в работах А. И. Лопырина [4], Ю. Д. Клинского [3]. В первых исследованиях для стимулирования роста фолликулов и контроля за овуляцией у овец были использованы гонадотропные препараты, полученные из мочи беременных женщин (хорионический гонадотропин, пролан) [9]. Дальнейшие исследования в этой области были направлены на изучение эффективных воздействий различных гипофизарных и плацентарных гормонов, определение дозы, способа и места введения препаратов и их сочетаний, обеспечивающих возможность контроля уровня полиовуляции, в том числе и для технологии трансплантации эмбрионов.
При индукции полиовуляции главной проблемой исследователи считают вариабельность ответа яичника на обработку [7]. Индивидуальная изменчивость в реакции яичников доноров отмечена даже при применении стандартных схем и доз гонадотропных препаратов. Более того, ни одна из проверенных и рекомендованных схем гормональной обработки не обеспечивает стабильного яичникового ответа.
Так, в экспериментах на овцах Т. Sugie, Т. Soma, J. Tsunoda, К. Muzouchi [10] с целью вызывания суперовуляции обрабатывали животных 1200 ед. СЖК (сыворотка жеребых кобыл) и ХГ (хорион гонадотропин) в дозе 800 ед. У 93 % овец обнаружено от 1 до 36 овуляций (в среднем 7,9 на 1 донора). В среднем было извлечено 4,2 яйцеклетки на 1 донора, 101 из которых были оплодотворенными, однако 50 % клеток оказались непригодными для пересадки.
В сообщении В. И. Донской [1], в случной сезон при обработке овец СЖК в дозе 1 200 м.е. и ХГ в дозе 800 ед. в среднем на одного донора овулировало 2 фолликула. Увеличение дозы СЖК до 1400-1700 ед. незначительно повысило уровень овуляции. При такой же дозе СЖК и дополнительном введении 1 000 ед. ХГ число овуляций в среднем составило 3,2, а при введении ПГФ2-альфа (простагландин Ф2-альфа) и ХГ - 3,4. При такой дозе СЖК 2 000-2 200 ед. в яичниках обработанных овец овулировало в среднем 18,2 фолликула с колебаниями от 7 до 25. Дальнейшее повышение дозы хотя и давало в некоторых случаях увеличение индекса полиовуляции, но сопровождалось кистозными изменениями в яичниках, увеличением числа атретических фолликулов и животных с «тихой охотой».
По данным Л. К. Эрнста и Н. И. Сергеева [5], введение овцам на 11 день эстрального цикла СЖК в дозе 1 000-1 200 ед. и через 48 часов 250 мкг ПГФ2-альфа обеспечивало в среднем 10 овуляций на каждого обработанного донора (при лимите от 3 до 36). Число нормальных эмбрионов составило 8,4 в среднем на одного положительного донора.
Таким образом, полученные данные по вызыванию полиовуляции свидетельствуют о том, что реакция яичников на введение экзогенных гормонов непредсказуема и отличается большой вариабельностью в отношении числа овуляций и выхода нормальных эмбрионов.
Следовательно, задача создания оптимальной схемы полиовуляции, дающей высокий процент ответов у доноров и достаточное количество полноценных эмбрионов, остается незавершенной и требует дальнейшего совершенствования.
Методика эксперимента
В эксперименте находилось 7 коз, у которых индуцировали полиовуляцию по оригинальной схеме: для синхронизации полового цикла в качестве пролонгаторов лютеиновои фазы использовали ушные импланты «Крестар» (действующее вещество норгестамет); для ее прерывания и стимуляции овогенеза - «Фоллигон» в дозе 500 ед. и «Оваген» в общей дозе 6,4 мл. Синхронность овулирования созревших фолликулов обеспечивали применением «Хорулона».
Наличие и продолжительность половой охоты определяли рефлексологическим методом (выборка с помощью козлов-пробников каждые 1-2 ч.). После выявления охоты коз двукратно осеменяли свежеполученной спермой высокого качества.
Уровень и качество полиовуляции определяли по результатам лапаротомии и осмотра яичников (наличие желтых тел) и вымывания клеток. К пригодным относили оплодотворенные ооциты, поделившиеся при дальнейшем инкубировании in vitro.
Для определения гормонального фона от коз через определенные промежутки времени получали кровь, в которой затем исследовали концентрацию половых гормонов методом иммунно-ферментного анализа.
Результаты эксперимента
По результатам выборки все обработанные животные пришли в охоту. Половая охота проходила при наличии и полноценном проявлении всех ее феноменов (положительная локомоторная реакция на самца, течка, рефлекс неподвижности). Продолжительность охоты значительно варьировала (табл. 1) и в среднем составила 28,7 ч.
При лапаротомии и вымывании эмбрионов выяснили, что нормальный ответ яичников на обработку был у 6 коз (№№ 7870, 7959, 7858, 7371, 7854, 7358), при этом количество овуляций варьировало от 11 до 24 у различных животных (табл. 2). В среднем реакция полиовуляции была 16 желтых тел. / гол., при выходе полноценных ооцитов 90,4 %.
В яичниках козы № 7976 отмечались изменения, характерные для гиперстимуляции. Они были увеличены (в среднем 5,7-5,2 см), неправильной формы. Имелось множество желтых тел и неовулировавших созревших фолликулов. Вымытые ооциты при микроскопии оказались неоплодотворенными,
Таблица 1. Сроки наступления и продолжительность индуцированной охоты у коз
|
Параметры |
№ животного |
М±т |
||||||
|
7870 |
7959 |
7858 |
7371 |
7854 |
7358 |
7976 |
||
|
Время от извлечения импланта до начала охоты, ч. |
15 |
12 |
18 |
14 |
14 |
14 |
12 |
14,14±0,77 |
|
Продолжительно сть охоты, ч. |
31 |
28 |
28 |
16 |
36 |
28 |
22 |
28,71±3,06 |
Таблица 2.
|
Параметры |
№ животного |
|||||||
|
7870 |
7959 |
7858 |
7371 |
7854 |
7358 |
7976 |
7870 |
|
|
Реакция полиовуляции, желтых тел (п.я./л.я.) |
16/9 |
7/4 |
4/11 |
5/6 |
11/10 |
5/8 |
42/48 |
16/9 |
|
Вымыто клеток, всего |
23 |
8 |
13 |
11 |
21 |
7 |
40 |
23 |
|
Из них пригодных для микроинъекций (клеток/%) |
23/100 |
4/50 |
12/92,3 |
11/100 |
21/100 |
7/100 |
0/0 |
23/100 |
недозрелыми, окруженными многослойным кумулюсом, часть клеток имела неправильную форму и неравномерное распределение жира, во время инкубации клетки погибли.
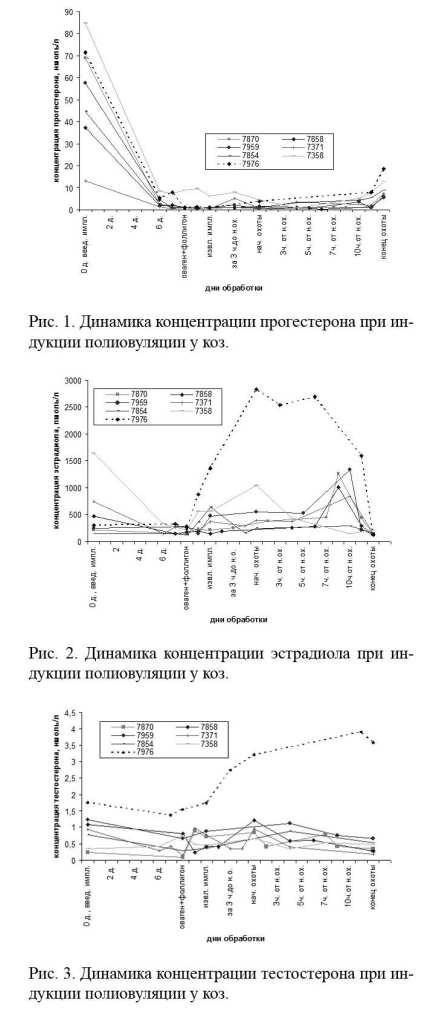
Уровень и динамика половых гормонов у коз во время фармакологической обработки представлены на рисунках 1-3.
Динамика прогестерона и эстрадиола в сыворотке крови у 6 нормально отреагировавших коз в целом изменялась в соответствии с последовательностью введения экзогенных гормонов и соответствовала изменениям в организме, связанным с индукцией искусственного эстрального цикла (рис. 1, 2). Большая разница в уровне гормонов у коз в начале обработки объясняется различными стадиями полового цикла, так как животных обрабатывали фронтально, без учета фазы цикла. Как видно на графиках, к 5-му дню обработки циклы у животных синхронизировались. Концентрация тестостерона варьировала в пределах 0,14-0,22 ннмоль/л.
В то же время оказалось затруднительным выявить прямую корреляционную связь между интенсивностью ответа при индукции полиовуляции и уровнем половых гормонов.
Так, например, у козы № 7870, давшей максимальное количество овуляций - 25 ж. т. (желтых тел) - уровень прогестерона был даже несколько ниже, чем у других животных, уровни эстрадиола и тестостерона не различались, а при этом от козы № 7358 с высокой концентрацией прогестерона и эстрадиола в течение всего эксперимента получили только 13 овуляций.
Обсуждение результатов
Таким образом, на основании полученных результатов можно констатировать, что примененная нами схема дала хорошие результаты полиовуляции с высокой степенью синхронизации овуляций, о чем свидетельствует процент одновозрастных клеток.
Однако наше исследование подтверждает и выводы вышеприведенных ученых о том, что даже при одинаковой гормональной обработке животных одной породы, сходных по фенотипу, при одном уровне кормления и содержания и прочих равных условиях имеют место разные ответы на индукцию полиовуляции.
Считаем, что в обсуждении следует также отметить частный случай гиперстимуляции яичников и получения ранних недоразвитых ооцитов у козы № 7976.
Причины дегенеративных изменений зародышей могут быть разными. По мнению J. Gordon [8], повышенный уровень прогестерона как следствие образования большого количества желтых тел в яичниках влияет на структуру эмбрионов и ведет к их дегенерации. Однако в наших исследованиях, несмотря на множество желтых тел, концентрация прогестерона у козы № 7976 находилась в пределах нормы и его динамика не отличалась от таковой у коз с нормальной полиовуляцией (рис. 1).
Другие исследователи считают, что основной причиной дегенерации эмбрионов является наличие в яичниках большого количества неовулировавших фолликулов, а следовательно и повышенного уровня эстрогенов [6]. В нашем случае, действительно, имело место большое количество овулировавших и неовулировавших фолликулов и уровень эстрадиола во время обработки превышал нормальный в 5-10 раз (рис. 2). То есть можно предположить, что повышенное содержание эстрадиола при преовуляторном развитии ооцитов вызывает задержку оогенеза.
Вероятно также, что анормальный рост концентрации эстрадиола и гиперстимуляция яичников произошли в связи с повышенным содержанием тестостерона (рис. 3), который, как известно, ароматизируется в эстрогены в гранулезных клетках яичников и в определенной степени участвует в регуляции гипофизом выработки половых гормонов, а также играет определенную роль в регрессии фолликулов. Концентрация тестостерона в начале обработки превышала средний уровень в 4 раза, еще существенно возросла при введении фолликулостимулирующих препаратов и к концу половой охоты была выше среднего уровня уже в 12,5 раз. Возможно, что введение экзогенных гонадотропинов на фоне высокого тестостерона спровоцировало его дальнейшее повышение и вызвало в результате гормональный сбой.
Интересно, что данная коза повторно пришла в охоту уже через 5 дней после операции, в дальнейшем наблюдали еще два естественных половых цикла (в анэстральный сезон), последний завершился оплодотворением и нормально развивающейся беременностью.
Список литературы
1. Донская, В. И. Сравнительная оценка различных способов стимуляции полиовуляции у овец./B. И. Донская, М. М. Кунижев // Разведение овец икоз.Шерстоведение: Сб. науч. Тр./ВНИИОК-Ставрополь, 1983.-С. 87-90.
2. Завадовский, М. М. Нельзя ли вызывая искусственную овуляцию у овец достигнуть многоплодия? / М. М. Завадовский, Л. П. Падучева // Труды по динамике развития. - 1935. -Т. IX. - С. 139-151.
3. Клинский, Ю. Д. Использование простагландинов для регуляции воспроизводительной функции овец / Д. Ю. Клинский, А. Н. Алексеенко // Животноводство. - 1980. - № 4. - С. 54-57.
4. Лопырин, А. И. Действие различных прогестагенных препаратов при стимуляции синхронизации охоты у овец / А. И. Лопырин, В. И. Донская, Л. П. Рак, П. В. Сурков // Овцеводство, 1969- № 8. - C. 27-30.
5. Эрнст, Л. К. Трансплантация эмбрионов сельскохозяйственных животных / Л. К. Эрнст, Н. И. Сергеев. -М. : Агропромиздат, 1989. - С. 127-129.
6. Booth, W. D. Plasma oestrogen and progesterone in relation to super ovulation and egg recovery in the sheep / W. D. Booth, R. Newcomb, H. Strange e.a. // Vet. Rec. - 1975. -V. 97. -N 19. -P. 366-369.
7. Erickson, G. F. The physiology of folliculogenesis: the role of novel growth factors / G. F. Erickson, S. Shimasaki // Fertil Steril. - 2001. - 76 (5). - 943-949.
8. Gordon J. The use of progesterone and serum gonadotropin (PMS) in the control of fertility in sheep. II. Studies in the extra seasonal production of lambs / J. Gordon // J. Agr. Sci. - 1985. - V. 50 - N 2.
9. Rowson, L. E. A. Methods of inducing multiple ovulation in sheep / L. E. A. Rowson // J. Endocrinol. - 1957.-N 7.-P. 260-270.
10. Sugie, T Superovulation of sheep using follicle stimulating hormone and prostaglandin F / T. Sugie, T. Soma, J. Tsunoda, K. Muzouchi // Theriogenology. - 1980.-V. 11.-N1.-P. 104.
Актуальные вопросы ветеринарной биологии № 2 (14), 2012



