Д. Тииргартен1, К. Сахсе2, Б. Ментрап1, К. Фей3, X. Хотзел4, О. Анхенн56
1 Institute of Pathology & Neuropathology (г. Эссен, Германия);
2 Institute of Bacterial Infections & Zoonoses (г. Иена, Германия);
3 Justus-Liebig University (г. Иена, Германия);
4 Institute of Molecular Pathogenesis (г. Иена, Германия);
5 General Hospital Hagen (г. Хаген, Германия);
6 University Duisburg-Essen Medical School (г. Эссен, Германия)
Сокращения: ПЦР — полимеразная цепная реакция; РНВП — рецидивирующая непроходимость воздухоносных путей; ХОБЛ —хроническая обструктивная болезнь легких
Введение
До недавнего времени данную патологию (РНВП) называли ХОБЛ. Она широко распространена среди лошадей [21] и характеризуется развитием бронхиолита [8, 29], как это происходит при ХОБЛ и легочной эмфиземе человека [27]. Предполагается, что основную роль в патогенезе упомянутых патологий играют пыль, содержащая органические вещества, и эндотоксины [17, 25].
Ранее с помощью ПЦР мы обнаружили Chlamydia psittaci у 38 % людей, страдавших ХОБЛ и эмфиземой легких [28,29]. Возбудитель локализовался в клетках альвеол и бронхиол. В последующем С. psittaci и Chlamydophila abortus обнаружили в мокроте пациентов с ХОБЛ [1]. У лошадей с острыми респираторными инфекциями хламидии находили очень редко [16,14]. Т.С. Мейр и Дж.М. Вилле [31] изолировали культивируемые хламидии в носовой полости и конъюнктиве у 5 % обследованных лошадей, но связи этой находки с какими-либо патологическими нарушениями они не установили. Однако редкое выявление хламидии в эпоху, предшествующую появлению ПЦР, можно объяснить трудностью культивирования этих облигатных внутриклеточных бактерий. При серологическом исследовании лошадей в Италии у 26,5 % обследованных животных обнаружили антитела к Chlamydophila pneumoniae в титре > 1:32. Некоторые сыворотки давали слабую положительную реакцию и с антигеном С. psittaci [3]. Тем не менее сообщалось о частом обнаружении С. psittaci в абортированных кобылами плодах [6, 26].
При проведении описываемой в этой публикации работы иммуногистохимическими методами, а также в реакциях иммунофлюоресценции и ПЦР исследовали пробы легочной ткани, взятые от клинически здоровых и больных РНВП лошадей на наличие хламидий/хламидофил. Пробы, признанные позитивными в ПЦР, дополнительно подвергли секвенсанализу для окончательной идентификации этих возбудителей.
Материалы и методы
Патологический материал. В трех районах Западной Вестфалии в период с ноября 2002 г. по октябрь 2004 г. было убито 948 лошадей, у 26 из которых диагностировали РНВП по следующим критериям: 1) наличию кашля на протяжении трех месяцев и более; 2) непереносимости физических нагрузок; 3) раздвоению фазы выдоха, раздуванию ноздрей, наличию носовых истечений; 4) частоте дыхания выше 20/мин; 5) гипертрофии mm. recti abdomini; 6) усилению тяжести симптоматики при нахождении животных в запыленных помещениях; 7) обнаружению при аускультации легких патологических шумов. Контролем служили 20 клинически здоровых лошадей, у которых перечисленные выше признаки РНВП отсутствовали. При убое от всех лошадей обеих групп брали пробы из 8 разных участков легкого и исследовали описанными ниже методами.
Шстологическое исследование. После фиксации формалином пробы легких заливали парафином (Tissuewax™; Med-ite GmbH, Германия). Из заливок на ротационном микротоме (Microm GmbH, Walldori, Germany) готовили срезы толщиной 3...7 мкм. Их окрашивали гематоксилином и эозином и исследовали под световым микроскопом, оценивая выявленные гистологические изменения бронхиол в баллах (0...4): 0 — отсутствие воспаления; 1 — обнаружение единичных лимфоцитов; 3 — легкое воспаление; 4 — тяжелое воспаление, сопровождающееся интралюминальным скоплением нейтрофилов. Данные, полученные при оценке 8 срезов из разных участков легкого каждого животного, суммировали. У одной лошади диагностировали паразитарное заболевание легких и в дальнейшей работе взятый от нее материал не исследовали.
Иммуногистохимическое и иммунофлюоресцентное исследования. При проведении иммуногистохимического исследования срезы легкого лошадей освобождали от парафина, обрабатывали мышиными антителами к С. psittaci (Biotrend, Германия) в разведении 1:60 в течение 2 ч при комнатной температуре, а затем пероксидазной системой Histostain®-Bulk-Kit (Zymed Lab., США).
При постановке реакции иммунофлюоресценции освобожденные от парафина срезы обрабатывали: 1) мышиными моноклональными ^С2Ь-антителами к С. psittaci (Biotrend) в разведении 1:100) и мышиными моноклональными IgGl-антителами к панцитокератину (BioCarta, США) в разведении 1:50; 2) 4',6-диамидино-2-фенилиндол-гидрохлоридом (Sigma, Германия) в рабочей концентрации 0,1 мкг/мл); 3) конъюгатами Alexa Fluor 488 с козьими антимышиными IgGl (в разведении 1:400) или Alexa Fluor 594 с антимышиными IgG2b (в разведении 1:400).
ПЦР. Пробы легких, предназначенные для исследования в ПЦР, хранили при -80 °С. ДНК из них изолировали с помощью High Pure PCR Template Preparation Kit (Roche Diagn, Германия). ДНК-экстракт (5 мкл) служил затравкой. Пробы исследовали на наличие С. psittaci/C. abortus и С. pneumoniae в модифицированном варианте гнездовой ПЦР [7], использующей в качестве мишени ген отрА. На первом этапе проводили родоспецифическую амплификацию праймерами 191СНОМР (5'-GCI YTI TGG GAR TGY GGI TGY GCIAC-3') и СНОМР-371 (5'-TTA GAAICK GAA TTGIGC RTTIAY GTGIGC IOCS'). Для второй амплификации использовали 1 мкл продукта первого этапа ПЦР и комбинацию праймеров 218PSITT (5'-GTA ATT TCI AGC CCA GCA CAA TTY GTG-3')/CHOMP336s (5'-CCR CAA GMT TTT CTR GAY TTC AWY TTG TTR AT-3') для С. psittaci и 201СНОМР (5'-GGI GCW GMI TTC CAA TAY GCI CAR TC-3')/PNEUM268 (5'-GTA CTC CAA TGT ATG GCA СТА AAG A-3') для С. pneumoniae. Специфические ампликоны имели следующие размеры: 576...597 пары оснований (родоспецифический продукт), 389...404 пары оснований для С. psittaci и 244 пары оснований для С. pneumoniae.
Тест проводили по следующей схеме [23]:
А. Родоспецифическое обнаружение хламидий. Готовили маточную смесь реагентов (50 мкл) из 1 мкл смеси dNTP (по 2 мМ каждого), 1 мкл праймера 191СНОМР (20 пмоль/мкл), 1 мкл праймера СНОМР371 (20 пмоль/мкл), 5 мкл реакционного буферного раствора (10х концентрации), 0,2 мкл Taq ДНК-полимеразы (5 Ед/мкл), 40,8 мкл Н2О. В качестве затравки добавляли в каждую смесь по 1 мкл ДНК-экстракта легочной ткани или 5 мкл экстракта смыва. Предусматривали контроли: позитивный — ДНК референтного штамма хламидий; негативный — воду вместо экстракта ДНК. ПЦР проводили в следующем температурном режиме: первичную денатурацию при 95 °С —30 с, 35 циклов денатурации при 95 °С —30 с, первичные отжиг при 50 °С — 30 с и вытяжение при 72 °С — 30 с. При правильной амплификации образовывался продукт размером 576...597 пар оснований, специфический для хламидий и хламидофил.
Б. Видоспецифическое обнаружение хламидий. Готовили маточную смесь реагентов (50 мкл) из 1 мкл смеси dNTP (по 2 мМ каждый), 1 мкл прямого праймера 201СНОМР и 1 мкл обратного праймера TRACH269 или PNEUM268 (по 20 пмоль каждого) или 1 мкл прямого праймера 204PECOR и 218PSITT и 1 мкл обратного праймера CHOMP336s (по 20 пмоль каждого), 5 мкл реакционного буферного раствора (10х концентрации), 0,2 мкл Taq ДНК-полимеразы (5 ед./мкл), 40,8 мкл воды. Добавляли в качестве затравки по 1 мкл продукта родоспецифической ПЦР. ПЦР проводили в следующем температурном режиме: первичную денатурацию при 95 °С —30 с, 20 циклов денатурации при 95 °С —30 с, первичные отжиг при 60 °С — 30 с и вытяжение при 72 °С — 30 с. При правильной апмлификации С. trachomatis, С. pneumoniae, С. psittaci и С. ресогшп образовывались продукты размером 250, 244,389...404 и 426...441 пар оснований соответственно.
Секвенирование ДНК. Для идентификации видов хламидий/ хламилофил продукты первого цикла амплификации вновь амплифицировали с применением праймеров 201СНОМР и СНОМР-336s. Вырезали специфические полосы продуктов ПЦР из 1%-го агарозного геля и экстрагировали ДНК с помощью QIAquick Gel Extraction Kit (QIAGEN, Германия). Перед проведением анализа на ABI PRISM 310 Genetic Analyzer (Applied Biosystems, Германия) провели цикличное секвенирование этих экстрактов с теми же праймерами, которые перечислены выше и реактивами BigDye™ Terminator Cycle Sequencing Ready Reaction Kit (Applied Biosystems). Средняя длина фрагментов составила 400 нуклеотидов. Для идентификации видов пользовались базой данных BLAST [32].
Результаты
На основании проведенных исследований и данных анамнеза 45 лошадей разделили на 2 группы — клинически здоровых и больных РНВП, а каждую из них на 2 подгруппы:
- клинически здоровые (20 гол.): без гистологических изменений легких (подгруппа I, 15 гол., рис. 1) и с легким бронхиолитом (II, 5 гол.), суммарная балльная оценка тяжести воспаления = 4...6);
- больные РНВП (25 гол.): без или со слабыми (0...5 баллов) гистологическими изменениями (III, 16 гол) и тяжелым (> 10 баллов) бронхиолитом (IV, 9 гол.).
При иммуногистохимическом исследовании проб легких клинически здоровых и больных РНВП лошадей вьювили значительные различия тяжести гистологических изменений (р = 0,010), общего и относительного количества эпителиальных клеток бронхиол с антигеном С. psittaci (р < 0,001 и р < 0,001 соответственно).
В подгруппах II и III распределение обнаруженных в эпителиальных клетках бронхиол телец-включений и антигена
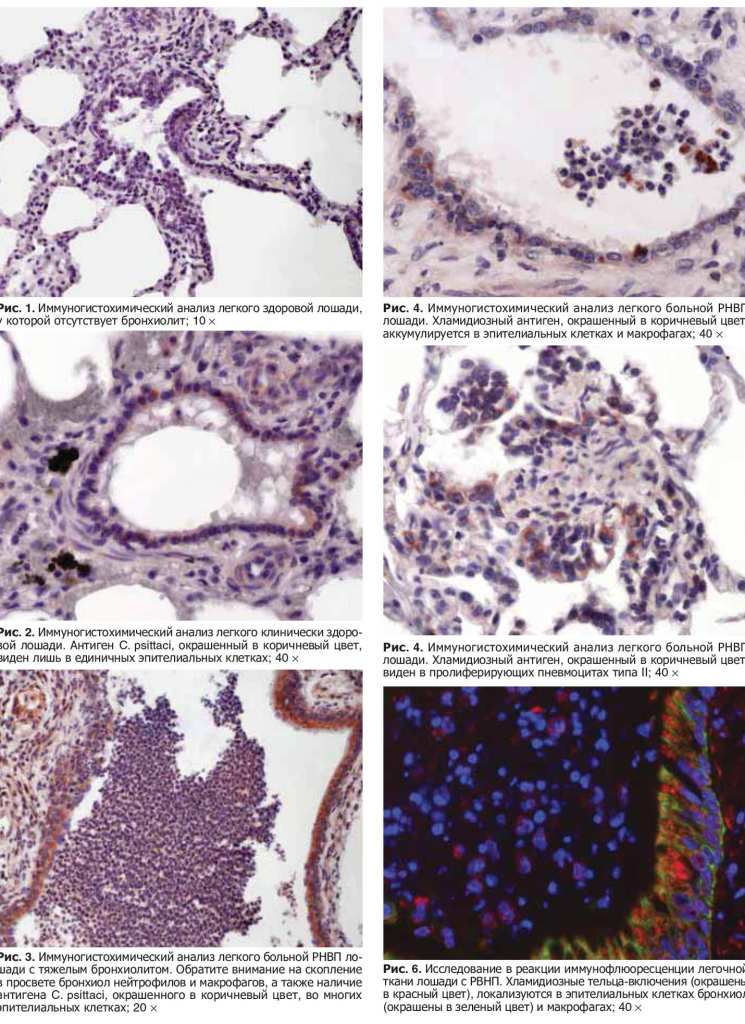
С. psittaci было типичным для персистентного хламидиоза: первых было мало, а антиген хламидий находили во многих клетках. У лошадей подгруппы I отмечали ту же, но слабее выраженную закономерность. У животных подгруппы IV средняя частота обнаружения клеток с хламидиозным антигеном в трех полях зрения микроскопа была вдвое большей, чем у всех остальных обследованных лошадей (83 и 42 соответственно; р = 0,037).
Хламидиозный антиген локализовался в эпителиальных клетках бронхиол (рис. 2,3 и 4) и иногда в пневмоцитах типа 2 (у 12 лошадей, в т.ч. у трех из подгруппы I, одной из подгруппы III и восьми из подгруппы IV), а также макрофагах (у 6 лошадей, в т.ч. одной из подгруппы I и пяти из подгруппы IV) (рис. 4 и 5). Между тяжестью болезни, частотой обнаружения хламидиозного антигена в макрофагах, пневмоцитах типа II и эпителиальных клетках бронхиол выявили положительную статистически значимую корреляцию.
Хламидиозные тельца-включения имели типичную морфологию и локализовались в перинуклеарном пространстве эпителиальных клеток бронхиол, реже макрофагов и гранулоцитов. Использование антицитокератиновых антител облегчало их обнаружение, т.к. они светились красным цветом на зеленом фоне (рис. 6).
При исследовании в ПЦР не выявили статистически значимых различий между клинически здоровыми и больными животными. ДНК С. psittaci обнаружили у 5 из 15 (33,3 %) лошадей подгруппы 1,4 из 5 (80 %) подгруппы II, 13 из 16 (81,2 %) подгруппы III и 2 из 9 (22,2 %) подгруппы IV Различия частоты обнаружения этой хламидий были статистически значимыми между подгруппами I и III, а также III и IV
Для идентификации возбудителя секвенировали ДНК 22 из 24 проб, признанных позитивными в реакции иммунофлюоресценции. Сравнение полученных результатов с базой данных А BLAST выявило 100%-ю гомологию с С. psittaci в 9 и с С. abortus в 13 случаях.
Обсуждение
Одна из характерных особенностей РНВП состоит в интенсивном образовании в дыхательном тракте слизи, содержащей большое количество нейтрофилов [4]. У людей при ХОБЛ также наблюдают гиперсекрецию слизи, но нейтрофилов в ней бывает много только в периоды рецидивов болезни [2]. Причинами последних обычно служат бактериальные и вирусные инфекции [22]. У больных РНВП лошадей отмечают повышение активности коллагеназ [31] и матриксных металлопротеиназ 8,9 и 13 [И, 19, 20, 31], которые служат удобными маркерами прогрессирования патологического процесса Высвобождение матриксной металло-протеиназы 9 непосредственно индуцирует протеин 60 теплового шока хламидий [10]. Матриксные металлопротеиназы играют важную роль в деструкции тканей макрофагами при эмфиземе легких [24], их повышенную концентрацию отмечают у людей также при ХОБЛ [30]. Концентрация хемокина IL-8 и опухолевого некротического фактора альфа повышается у лошадей при обострениях РНВП [4, 5] и у людей с ХОБЛ [9]; происходит это и при инфекции С. psittaci [18]. РНВП и ХОБЛ считают мультифакторыми болезнями, причем основную роль в их патогенезе приписывают внешним причинам — пыли, сигаретному дыму и т.д. Не отрицается роль и генетических факторов [13,15].
Как показало проведенное нами исследование, антигены хламидий локализуются в легких лошади преимущественно в эпителиальных клетках бронхиол и в меньшей степени в пневмоцитах типа II и макрофагах. Антигенная нагрузка этих клеток лошадей с РНВП значительно выше, чем у здоровых животных. Поскольку при данной патологии воспаление инициирует ингаляция пылевых частиц, то эпителий бронхов, по всей видимости, является ключевой структурой в патогенезе болезни. Сопутствующая инфекция этих клеток хламидиями может сделать патологический процесс хроническим, а также усилить тяжесть воспалительной реакции и разрушения тканей.
Характер распределения антигена С. psittaci в легких клинически здоровых лошадей (подгруппы I и II) был типичным для персистентной инфекции, а у больных РВНП животных с тяжелыми гистологическими изменениями легких (подгруппа IV) — для острой хламидиозной инфекции. Клинически здоровые лошади, у которых в легких выявили легкое воспаление и интенсивную нагрузку клеток антигеном хламидий (подгруппа II), скорее всего, находились на предклинической стадии болезни. Хотя гистологическая картина легких у этих животных была такой же, как у лошадей подгруппы III, но у последних проявлялась симптоматика РНВП. Такие клинические различия могли иметь лишь функциональную, вероятно, генетическую основу.
В ПЦР выявили значительные различия между клинически здоровыми и заболевшими РВНП, но не имеющими выраженного бронхиолита лошадьми, а также между последними и животными с тяжелыми поражениями легких. В свете таких наблюдений, указывающих на участие хламидий в патогенезе РНВП, следует по-новому взглянуть на сходные болезни человека и изучить роль, которую играют в их возникновении Chlamydiaceae sp.
Заключение
Впервые установлена персистенция С. psittaci и С. pneumoniae в легких клинически здоровых лошадей, а также показано, что она может приобретать острый характер (вероятно, во время рецидивов, вызванных дополнительными патогенными факторами). В таком контексте усматривается связь воспаления бронхиол с активированием инфекции этих агентов. Необходимо отнестись с большим вниманием к лошадям как к резервуару хламидий/хламидофил, особенно в свете недавно описанных хламидиозных абортов кобыл [6, 26]. Сходство патогенеза и гистологических изменений РНВП и ХОБЛ диктует необходимость оценки риска, которому подвергается персонал, обслуживающий лошадей.
БИБЛИОГРАФИЯ
1. Anhenn О., Theegarten D., Hotzel H. et al. J Budapest, Pauker Nyomdaipari Kft, 2004, 245.
2. Barnes P. New Engl J Med, 2000, 343, 269—280.
3. Di Francesco A., Donati M., Mattioli L. et al. New Microbiol, 2006, 29, 303—305.
4. Franchini M., Gilli U., Akens M.K. et al. Vet Immunol Immunopathol, 1998, 66, 53—65.
5. Giguere S., Viel L, Lee E. et al. Vet Immunol Immunopathol, 2002, 85, 147—158.
6. Henning K., Sachse K., Sting R. Dtsch Tierarztl Wschr, 2000, 107, 49—52.
7. Kaltenboeck В., Schmeer N., Schneider R. J Clin Microbiol, 35,1835—1841.
8. Каир F.J., Drommer W., Damsch S., Deegen E. Equine Vet J, 1990,22,349—355.
9. Keatings V.M., Collins P.D., Scott D.M., Barnes P.J. Am J Respir Crit Care Med, 1996, 153,530—534.
10. Kol A., Sukhova G.K., Lichtman A.H., Libby P. Circulation, 1998, 98, 300—307.
11. Nevalainen M., RauloS.M., Brazil T.J. etal. Equine Vet J, 2002, 34, 150—155.
12. MairT.S., Wills J.M. Vet Rec, 1992,130, 417^419.
13. Marti E., Gerber H., Essich G. et al. Equine Vet J, 1991, 23, 457-^60.
14. McChesney S.L., England J.J., McChesney A.E. Cornell Vet, 1982, 72, 92—97.
15. Molfino N.A. Chest, 2004, 125,1929—1940.
16. Moorthy A.R., Spradbrow P.B. Equine Vet J, 1978,10, 38-^t2.
17. Pirie R.S., Collie D.D.S., Dixon P.M., McGorum B.C. Clin Exp Allergy, 2003, 33, 676—683.
18. Rasmussen S.J., Eckmann L, Quayle A.J. et al. J Clin Invest, 1997, 99, 77—87.
19. RauloS.M., SorsaT.A., Kiili M.T., Maisi P.S. Am J Vet Res, 2001, 62, 1142— 1148.
20. Raulo S.M., Sorsa Т., Tervahartiala T. et al. Vet J, 2001, 33,128—136.
21. Robinson N.E., Derksen F.E., Olszewski M.A. et al. Brit Vet J, 1996, 152, 283— 306
22. Rohde G., Wiethege A., Borg I. et al. Thorax, 2003, 58, 37^2.
23. Sachse K., Hotzel H. Methods Mol Bid, 2002, 216,123—136.
24. Shapiro S.D. Am J Respir Crit Care Med, 1999, 160, 29—32.
25. Simonen-Jokinen Т., Pirie R.S., McGorum B.C., Maisi P. Equine Vet J, 2005, 37, 412-17.
26. Szeredi L, Hotzel H., Sachse K. Vet Res Commun, 2005, 29, 37 9.
27. Theegarten D., Teschler H., Stamatis G. et al. Pneumologie, 1998, 52, 702—706.
28. Theegarten D., Mogilevski G., Anhenn O. et al. Virchows Arch, 2000, 437, 190— 193.
29. Theegarten D., Anhenn O., Hotzel H. et al. BMC Infect Dis, 2004, 4, 38.
30. Thuribeck W.M., Lowell F.C. Am Rev Respir Dis, 1964, 89, 82—88.
31. VernooyJ.HJ., LindemanJ.H.N., Jacobs J.A. etal. Chest, 2004, 126, 1802— 1810.
32. von Fellenberg R. Tierarztl Prax, 1987, 15, 399-^07.
33. Blast search [http://www.ncbi.nlm.nih.gov/blast/].
Российский ветеринарный журнал №4 2008