ПОДБОР И ОЦЕНКА ИНФОРМАТИВНОСТИ ISSR-МАРКЕРНЫХ СИСТЕМ У ЛОШАДЕЙ
Курнлееко Ю.Ф., Супруе И.А., Костееко С.А.
Национальный университет биоресурсов и природопользования Украины Киев. Украина
Введение. Мониторинг генетического полиморфизма популяций является одной из важных составляющих программ сохранения и воспроизводства различных сельскохозяйственных видов, в том числе лошадей. Метод амплификации межмикросателлитнпх фрагментов ДНК позволяет оценить биологическое разнообразие путем анализа участков ДНК, расположенных между двумя инвертированными SSR-локусами генома (ISSR-PCR) [1, 4 ,5, 9]. По сравнению с другими методами мультилокусного профилирования метод ISSR-PCR характеризуется лучшей воспроизводимостью и эффективно используется для выявления внутривидовой и межвидовой генетической изменчивости, идентификации видов и популяций [10,11].
С этой целью проведен поиск полиморфных ISSR-маркеров для изучения генетического разнообразия популяций лошадей двух видов (Equus caballus и Equus przewahkii).
Цель работы - подбор информативных маркерных систем для ISSR-типпрования в коневодстве.
Материал и методика исследований. Для проведения исследований были отобраны образцы биологического материала у 176 представителей 7 популяций лошадей (арабская, орловская рысистая, тракененская, новоалександровский тяжеловоз, чистокровная верховая, украинская верховая породы, лошади Пржевальского). Геномную ДНК выделяли из волосяных фолликулов лошадей с собственными модификациями [2] с помощью комплекта реактивов «ДНК-сорб В» (АмплиСенс, Россия) в соответствии с рекомендациями производителя. Начальный этап лизиса проводили в течение 2 часов при 65°С.
Концентрацию ДНК и степень ее чистоти определяли с помощью прибора NanoDrop. Амплификацию проводили на амплификаторе "Терцик" (Россия) в следующем температурном режиме: начальная денатурация - 4 мин при температуре 94 С; 32 цикла: 30 с при 94 °С, 30 с при 58 °С, 2 минут при 72 °С; 5 минут при 72 °С.
Реакционная смесь объемом 20 мкл содержала: 67 мМ Tris-HCl (pH 8,8), 17 мМ (NH4) 2SO4, 0,01% Tween-20, 0,2 мМ дНТФ, 1,0 ед. Tag-полимеразы, 40-80 нг ДНК, 1,5-1,8 мМ MgCl2 и 0,4-0,5 мкМ праймера. Оптимальную концентрацию каждого из компонентов реакции подбирали экспериментально.
Электрофоретическое разделение продуктов амплификации проводили в 1,5%-ном агарозном геле, используя 0,5 х ТВЕ-буфер при постоянном напряжении 100 В в течение 80 минут. После окончания электрофореза гель обрабатывали бромистым этидием (0,5 мкг / мл), визуализировали под УФ-лучами и фотографировали цифровой камерой Panasonic DMC-FS42. Для определения молекулярной массы использовали маркер GeneRuler 100 bp ("Fermentas", Литва).
Результаты исследований и их обсуждение. Праймеры, которые были избраны нами для проведения исследований на начальных этапах запланированной работы и отвечали требованиям получения спектров ампликонов высокой воспроизводимости и специфичности для оценки межпородной дифференциации, генетической гетерогенности популяций, были использованы рядом авторов на других биологических объектах сельскохозяйственного назначения [5.6.8]: S1 - (СТС)6А, S2 -(AGC)6G, S3 - (TCG)6G, S4 - (СТС)«С, S5 - (GAG)6G, S6 - (GTG)6A, S7 - (CCA)6G, S8 - (GCT)6A, S9 - (AGC)6C, S10 - (ACC)6G.
В исследованиях некоторых авторов [3,7] выявлено, что использование праймеров к трехнуклеотидным микросателлитным повторам позволяет получить спектр с большим количеством фрагментов, в том числе и полиморфных по сравнению с динуклеотидными.
Согласно анализа данных, полученных при использовании метода ISSR-PCR нами был сделан вывод о существовании универсальных праймеров, способных к выявлению генетического полиморфизма не только на уровне различных видов, но и других таксономических единиц. Таким универсальным пранмером ГЩР-анализа является фрагмент микросателлитных локусов с коровой последовательностью (AGC) на основе которого были созданы праймеры S2 и S9, оказавшиеся пригодными к определению внутри- и межпородного полиморфизма генома лошадей.
На первом этапе нашей научной работы проведен скрининг 10-ти маркерных систем на основе трехнуклеотидных праймеров с различными коровоми последовательностями и якорными нуклеотидами на З'-конце (табл. 1).
Таблица 1. Характеристики использованных праймеров
|
№ |
Праймер |
Повтор |
Нуклеотидная последовательность 5—>3 |
|
S1 |
(CTC)sA |
(CTC)e |
CTC CTC СТС СТС СТС СТС А |
|
S2 |
(AGC)6G |
(AGC)6 |
AGC AGC AGC AGC AGC AGC G |
|
S3 |
(TCG)6G |
(TCG)6 |
TCG TCG TCG TCG TCG TCG G |
|
S4 |
(СТС)6С |
(CTC)6 |
СТС СТС СТС СТС СТС СТС С |
|
S5 |
(GAG)6G |
(GAG)6 |
GAG GAG GAG GAG GAG GAG G |
|
S6 |
(GTG)sA |
(GTG)6 |
GTG GTG GTG GTG GTG GTG A |
|
S7 |
(CCA)6G |
(CCA)6 |
CCA CCA CCA CCA CCA CCA G |
|
S8 |
(GCT)6A |
(GCT)e |
GCT GCT GCT GCT GCT GCT A |
|
S9 |
(AGC)6C |
(AGC)6 |
AGC AGC AGC AGC AGC AGC С |
|
S10 |
(ACC)6G |
(ACC)6 |
ACC ACC ACC ACC ACC ACC G |
Низкие значения PIC (polimorphic index content) при типировании по САС маркерам у лошадей, полученные Воронковой В.Н. (2011) [7] позволили нам исключить эту коровую последовательность из перечня проанализированных нами праймеров. В тоже время в исследованиях данного автора при ISSR-TiiniipoBaHini лошадей наилучшим образом зарекомендовали себя GAG и АСС маркеры.
Спектры амплификации продуктов ISSR-PCR, полученные в результате первоначального скрининга праймеров, имели следующие характеристики: отсутствие ампликонов, диффузные спектры без четких дискретных полос и спектры с четкими ПЦР-продуктами (рис. 1).
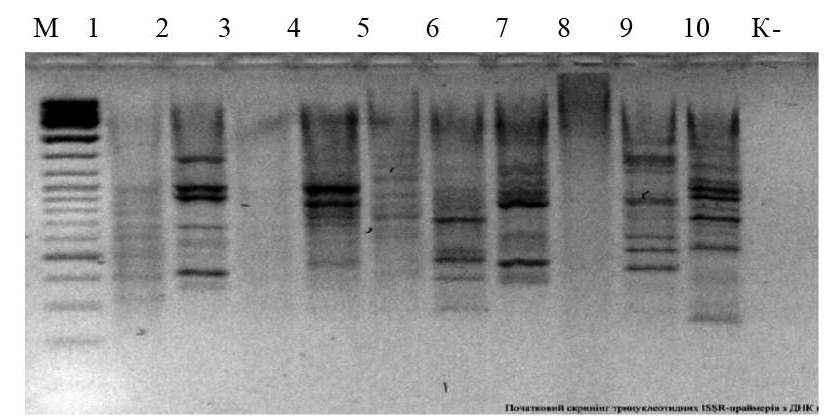
Рис. 1 Скрининг ISSR-праймеров с трехнуклеотидними коровими последовательностями: М - маркер молекулярных размеров (GeneRuIer DNA Ladder Mix. Fermentas). 1 - праймер (СТС)вА, 2 - (AGC)6G, 3 - (TCG)6G, 4 - (CTC)6C, 5 - (GAG)6G. 6 -7 - (CCA)6G. 8 - (GCT)6A. 9 - (AGC)6C. 10 - (ACC)6G.
По результатам проведенного скрининга праймеры S3 и S8 оказались непригодными дня оценки генетического полиморфизма, поскольку не воспроизводили ПНР - продукта. Объяснить это можно отсутствием в геноме исследованных лошадей микросателлитных локусов с таким количеством повторов или особенностью их образования и эволюции (наличие несовершенных повторов). Для праймеров S1 и S5 были характерны диффузные спектры без четких дискретных полос. Ввиду того, что ПЦР позволяет эффективно амплифицировать локусы, расстояние между которыми составляет не более 3 тыс. п.н., такая картина может свидетельствовать о расположении инвертированных локусов на большем расстоянии друг от друга. Отсутствие дискретных полос при электрофоретическом разделении может быть связано также с большим количеством этих микросателлитов в геномах.
С использованием праймеров S2 , S4 , S6 , S7 , S9 , S10 были получены четкие зоны амплификации. Однако в дальнейшем для оценки внутривидового полиморфизма лошадей мы применяли маркерные системы (S2 , S6 , S9 , S10), имеющие сравнительно большее количество локусов. Общее количество ампликонов варьировало в зависимости от микросателлитных последовательностей праймера и якорного нуклеотида.
При повторной амплификации геномной ДНК одного и того же животного не всегда воспроизводится весь спектр продуктов амплификации. Для анализа использовали только четкие ПЦР - локусы которые воспроизводились не менее чем в 3-4 независимых экспериментах. Диффузные, низкомолекулярные фрагменты длиной 80-150 п.н., которые не воспроизводились при повторных экспериментах, нами не учитывались. Каждый продукт амплификации рассматривали как отдельный локус.
Всего при использовании 4 ISSR - праймеров было получено 74 продукта амплификации ДНК лошадей, 54 из которых (72,97 %) были полиморфными (табл. 2.).
Таблица 2. Общая характеристика ISSR ампликоеов лошадей
|
Маркерная система |
Праймер |
Общее количество локусов |
Количество полиморфных локусов |
Уровень полиморфизма, % |
PIC |
Маркерный индекс |
|
S2 |
(AGC)eG |
19 |
15 |
76,47 |
0,207 |
3,9 |
|
S6 |
(GTOeA |
14 |
11 |
78,57 |
0,255 |
3.5 |
|
S9 |
(AGC)6C |
17 |
9 |
46,67 |
0.146 |
2,5 |
|
S10 |
(ACC)6G |
24 |
19 |
79,17 |
0,237 |
5,7 |
|
|
£ |
74 |
54 |
72,97 |
0,211 |
- |
Общее количество ПЦР-локусов вариировало от 24 (для праймера (АСС) 6G) до 14 (для праймера (GTG) бА), количество полиморфных локусов от 19 ((АСС) 6G) до 9 ((AGC) 6С). Примеры полученных спектров амплификации приведены на рисунках 2-3.
Весь спектр продуктов амплификации разделили на 3 части: область «тяжелых» фрагментов (более 1000 п.н.), включавшая в себя наиболее длинные фрагменты ДНК; область ампликонов среднего диапазона (500-1000 п.н.) и наиболее короткие низкомолекулярные фрагменты размером 300-500 п.н. При использовании праймера (АСС) 6G получено наибольшее общее количество ПНР-бэндов, наибольшее количество полиморфных ампликонов - 24 и 19 соответственно и высокий уровень полиморфизма (79.17%) среди всех использованных в работе ISSR-праймеров. Длина полученных продуктов ПЦР находилась в диапазоне от 260 до 1430 п.н. В спектрах праймера (АСС) 6G преобладали продукты ПЦР со средним размером 500-1500 п.н. -63,16%, доля низкомолекулярных ампликонов размером менее 500 п.н. составила 36,84%.
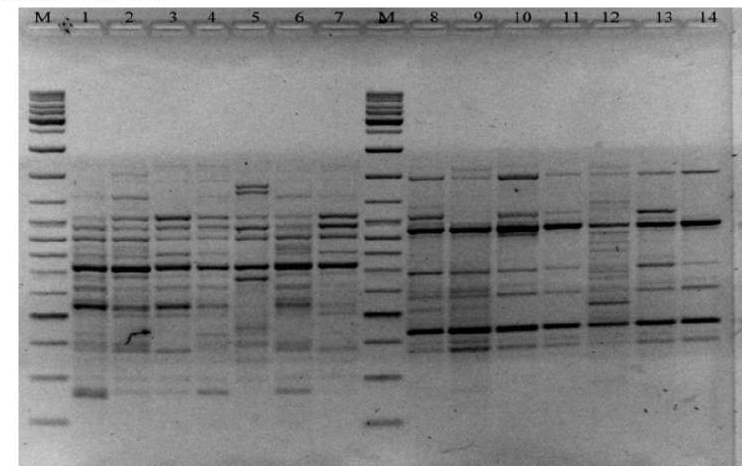
Рис. 2. Электрофореграммаразделения продуктов амплификации -PCR лошадей за использование праймеров (АСС) eG (1-7) и (AGC) eG (8-14): М - маркер молекулярных размеров (GeneRuler DNA Ladder Mix. Fermentas), 1, 8 - арабская. 2. 9 - лошади Пржевальского. 3, 10 - орловская рысистая, 4, 11 - тракененская, 5, 12 - новоалександровский тяжеловоз, 6, 13 - чистокровная верховая, 7, 14 - украинская верховая порода.
При использовании праймера (AGC) 6G с ДНК лошадей различных пород получено 19 продуктов амплификации. 15 из которых (76,47%) были полиморфными. Длина ампликонов составляла 270 п.н. - 1400 п.н. Подавляющее большинство ПЦР-локусов, полученных с этим праймером. были среднего размера, что составляло 83,33% от общего количества локусов. Четыре ПЦР-локуса были длиной менее 500 п.н. (16,67%).
В мультилокусних спектрах амплификации праймера (GTG) бА было получено 14 воспроизводимых ПЦР продуктов размером от 300 п.н. до 1120 п.н., 11 из которых оказались полиморфными и имели длину, соответствующую среднему диапазону. Таким образом, уровень полиморфизма для спектров с этим праймером и доля ПЦР- локусов среднего диапазона (11) составили 78,57%. Одним из наиболее распространенных показателей информативности маркеров, полученных при использовании этого или иного ПЦР-метода, является маркерный индекс (МкИ). Этот показатель позволяет учитывать мультилокусность спектров амплификации ДНК фингерпринту с использованием полимеразной цепной реакции.
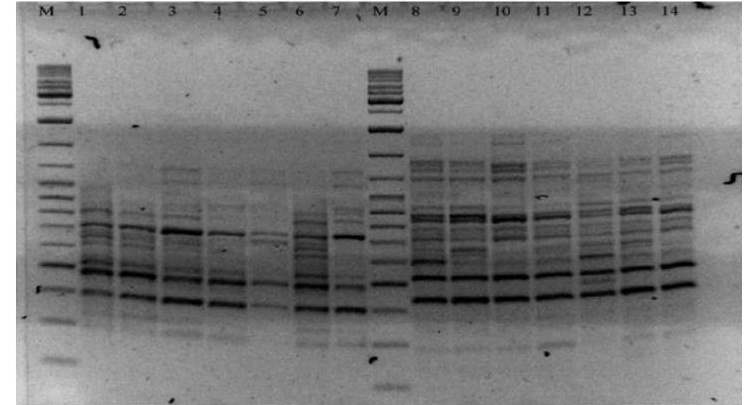
Рис. 3 Электрофореграмма разделения продуктов амплификации ISSR-PCR с ДНК лошадей за использование праймеров (GTG) sA (1-7) и (AGC) 6С (8-14). 1, 8 -арабская, 2. 9-лошади Пржевальского. 3. 10 - орловская рысистая, 4, 11 - тракененская. 5, 12 - новоалександровский тяжеловоз, 6. 13 - чистокровная верховая, 7, 14-украинская верховая порода
Наименьшее количество полиморфных ампликонов (9) и низкое значение маркерного индекса (2,5) получено с праймером ( AGC ) 6С, уровень полиморфизма составил 46,67 %. Всего при использовании этого праймера ISSR - спектры состояли из 17 продуктов ПЦР длиной 420-1450 н.п. Как и в случае предыдущего праймера, подавляющее большинство ПЦР - локусов (15) имели средний размер (500 -1500 п.н.), что составило 88,24 % от общего количества локусов. Доля локусов с наименьшими размерами до 500 п.н. составила 11,76 %.
Анализ спектров продуктов амплификации участков между инвертированными повторами микросателлитных локусов осуществляли при использовании трехнуклеотидних праймеров с последовательностями: (АСС) 6G , (AGC) 6G, (GTG) 6A и (AGC) бС. Следует отметить, что для всех протестированных праймеров ((ACC)6G, (AGC)UG, (GTG)6A и (AGC)6C) не обнаружены воспроизводимые ампликоны с размером более 1500 п.н. Значение маркерного индекса варьировало в зависимости от праймера. Высокие значения маркерного индекса получили для праймеров (АСС) 6G (5,7) и (AGC) 6G (3,9), что свидетельствует о большей информативности данных ISSR - праймеров для дифференцирования исследованных популяций лошадей. Для других двух праймеров величина МкИ была достоверно ниже ( р < 0,05, табл. 2)
Заключение. Таким образом, установлено, что количество продуктов амплификации (спектры ампликонов) и их полиморфизм значительно варьируют в зависимости от корового мотива микросателлитов, используемого в качестве праймера. ISSR-S2 и S10 системы являются наиболее информативными для анализа полиморфизма ДНК лошадей, по которым амплифииируется около 20 локусов генома и наблюдается межпородная и внутрипородная дифференциация.