Барсегян Л. С, Сухарев О. И., Куликов Е. В.
ФГБОУ ВПО «Российский университет дружбы народов».
Инфекционный вирусный перитонит кошек (ИВПК), Feline infectious peritonitis (FIP) - фатальное иммуноопосредованное инфекционное заболевание кошачьих, про-текающее в подострой или хронической форме и вызываемое вирусом семейства Coronaviridae. Болезнь проявляется в двух основных формах: экссудативной (влажной) и пролиферативной (сухой) [1, 8].
Историческая справка
Впервые ИВПК был описан Jean Holzworth в 1963 году в Бостонском ветеринарном центре Angell Memorial Animal Hospital как «фатальное расстройство у кошек». В 1964 году Feldman и Jortner представили первое описание FIP на конференции, проводившейся в этом же учреждении. Первое предположение о вирусной этиологии ИВПК высказали Wolfe и Griesemer в 1966 году, что было подтверждено позднее. В 1968 году Zook и сотр. наблюдали скопления вирусных частиц в тканях экспериментально зараженных кошек, но тогда они не смогли охарактеризовать точную природу агента. В период с 1970 по 1972 гг. Montali и Strandberg были описаны экссудативная и неэкссудативная формы течения инфекционного вирусного перитонита кошек. Выделение вируса и его идентификация как вируса семейства Coronaviridae выполнены в 1970 г. (Ward), а в 1978 г. Pedersen и соавторы доказали тесную генетическую связь между возбудителем инфекционного перитонита кошек (FIPV) и коронавирусами собак и свиней. В 1981 г. были опубликованы данные о причинно-следственной связи между вирусом коронавирусного энтерита кошек (FECV) и FIP, но только спустя почти 17 лет, в 1998 г., было доказано, что FIPV является самостоятельным возбудителем и происходит при мутации FECV [по 7].
Этиология
Возбудитель ИВПК - РНК-содержащий вирус, принадлежащий к роду Alphacorona-virus I (AlphaCoVI), семейству Coronaviridae. К этому семейству также относятся возбудители других значимых заболеваний для животноводства, таких как инфекционный бронхит кур (ИБК), инфекционный гастроэнтерит свиней (ИГС), коронавирусная диарея ново-рожденных телят (ДНТ), синюшная болезнь индюков (СБИ), коронавирусная инфекция собак (КВС), тяжелый острый респираторный синдром (атипичной пневмонии) и др.
Родовое название «кошачий коронавирус» (FCoV) широко использовалось для обозначения всех серотипов и биотипов возбудителя ИВПК. Такое использование общего термина FCoV привело к путанице при рассмотрении в международной литературе, потому что часто бывает трудно, а порой и невозможно определить, какой биотип вируса обсуждается или учитывается в конкретной работе. Чтобы избежать этого, стали использовать обозначение FECV для вируса коронавирусного энтерита кошек, присутствующего практически во всех популяциях кошек и редко проявляющегося клинически, и FIPV при обозначения биотипа, вызывающего инфекционный перитонит у отдельных животных [3].
Споры о происхождении вируса FIPV продолжаются до сих пор, но сегодня доказано, что FIPV возникает в результате мутации возбудителя коронавирусного энтерита кошек (FECV), хотя некоторые авторы до сих пор относят FIPV к высоковирулентному штамму FECV Теория о мутантном происхождении FIPV также хорошо объясняет спорадичность и неэпидемичность возникновения вирусного перитонита кошек в больших популяциях [6, 7].
Коронавирусы кошек делят на два серо-типа, которые определяются антигенными свойствами. Наиболее распространен в кошачьих популяциях вирус серотипа I. Вирусы серотипа II, которые, в отличие от первого, могут хорошо размножаться в культуре клеток, являются рекомбинантами между FCoVs типа I и собачьим коронавирусом. В дополнение к двум серотипам существует большое количество штаммов в каждом серотипе кошачьих коронавирусов. Различия между изолятами в пределах одной группы кошек редко превышают 1-2 %, но в географически удаленных регионах они могут составлять до 20 %. Важно отметить, что обе мутации FECV в FIPV могут произойти в любом штамме каждого из серотипов [8].
При изучении FIPV, выделенных из патологического материала, более чем в 70 % случаев обнаруживалась мутация в гене ЗС, который кодирует небольшой белок с неизвестной функцией. Потеря функции этого гена не мешает репликации вируса в естественных условиях или in vitro, но, как полагают, радикально меняет клеточный тропизм от клеток эпителия кишечника на макрофаги [1, 3].
Также группой ученых из Утрехтского университета после секвенирования генома большого числа FIPV и FECV была обнаружена вторая мутация, возникающая практи-чески во всех FIPV Эта мутация состояла из одной или нескольких нуклеотидных замен в гене полипептида S, которые вызывают незначительные изменения в аминокислот-ном составе последнего. Стоит обратить внимание на то, что комплекс мутаций, вызывающих превращение FECV в FIPV, уникален для каждого животного! Различия вируса имеются даже при возникновении клинической формы вирусного перитонита у котят из одного помета [6].
Эпизоотологические данные
Заболеванию ИВПК подвержены домашние и дикие кошки. В литературе встречаются упоминания случаев развития болезни у африканского льва, манула, леопарда, гепарда, ягуара, рыси, каракала, сервала [8].
В 2010 г. подробно описана клиническая картина FIP у самца пумы, которого подвергли эвтаназии из-за симптоматики, сходной с инфекционным перитонитом. Патолого-анатомическое вскрытие и гистопатологическая экспертиза показали некротический мультифокальный миокардит; некротический нейтрофильный и гистиоцитарный миозит и васкулит мышечной оболочки тонкого и толстого кишечника; интерстициальную пневмонию. Агент коронавирусной природы был обнаружен в сердце и ткани кишечника с помощью иммуногистохимии. ПЦР-исследование на коронавирусную инфекцию, выполненное с материалом ткани почки, было положительным, что под-твердило диагноз FIR Хотя положительный анализ на наличие FECV у пум встречался и ранее, это был первый описанный случай заболевания данного вида вирусным перитонитом [9].
При экспериментальном заражении заболеванию подвергаются белые лабораторные мыши и хорьки. ИВПК регистрируется повсеместно среди всех возрастных, половых и породных групп кошек. Вирусы серотипа I распространены преимущественно в странах Европы и Северной Америки. Вирусы серотипа II чаще встречаются в азиатских и африканских странах. В США более 90 % кошек серопозитивны по FECV, в питомниках количество серопозитивных животных несколько ниже (около 60 %). Но следует учитывать, что только в 8-10 % случаев происходит мутация FECV в FIPV. По некоторым данным именно домашние кошки, содержащиеся на свободном выгуле, или бездомные кошки являются основным источником инфицирования FECV диких кошачьих. FIP является причиной смерти кошек от инфекционных болезней только в 1-5 % случаев. Для сравнения: смертность котят от панлейкопении составляет около 30 % от всех случаев гибели [8].
Патогенез и клиническая картина
Исходя из литературных данных, можно выстроить следующую схему патогенеза инфекционного вирусного перитонита кошек, которая представлена на рисунке 1.
В дальнейшем развитие болезни по экссудативному или неэкссудативному типу зависит от степени поражения сосудов в организме. Вовлечение в процесс большого количества кровеносных сосудов с увеличением их проницаемости приводит к скоплению богатого белками выпота в полостях тела и других пространствах, иногда включая сердечную сумку и мошонку. При поражении меньшего количества сосудов течение инфекционного перитонита хронизируется без вы-потных процессов. У домашних кошек чаще всего наблюдается выпотная форма болезни.
Инкубационный период FIP при экспериментальном заражении составляет около 14 дней при экссудативной форме и до нескольких недель при развитии «сухой» формы. Самые ранние признаки развития FIP, помимо задержки развития у молодых кошек, включают в себя постепенное ухудшение состояния, общее недомогание, перемежающуюся фебрильную или пиретическую лихорадку, отсутствие аппетита и потерю веса. Другие признаки болезни накладываются на эти в зависимости от формы течения болезни и вовлечения в патологический процесс других органов [7, 8].
Увеличение объема живота является наиболее выраженным симптомом экссудативной формы FIP. При этом объем живота быстро увеличивается и количество асцитной жидкости превосходит асцит, возникающий при сердечно-сосудистых заболеваниях, новообразованиях, болезнях печени и почек. При пальпации брюшная стенка напряжена и болезненна. Кроме брюшной полости выпот может происходить также в грудную полость, мошонку, перикард, около суставную капсулу, вызывая соответствующую клиническую картину. Распространение патологического процесса на другие органы приводит к появлению симптомов гепатита, панкреатита, пневмонии, гидроперикардита, артрита, синовита, миозита (реже), нефрита, прогрессирующей почечной, сердечно-сосудистой и дыхательной недостаточности [7, 8].
Клиническая картина при неэкссудатив-ной форме вирусного перитонита неспеци-фична. Отмечается ухудшение общего состояния, лихорадка, быстрая прогрессирующая потеря веса, вплоть до полного истощения. У 60 % животных в патологический процесс вовлекаются глаза (увеиты, помутнение стекловидного тела, лимфоцитарная инфильтрация сосудов сетчатки, пиогранулема сетчатки) и нервная система, в особенности ЦНС (менингит, парез задних конечностей, нарушение координации движений, гиперестезия, судороги и паралич плечевого, тройничного, лицевого и седалищного нервов) [7, 8].
Диагностика
Лабораторная диагностика FIP на сегодняшний день затруднительна. Высокое генетическое родство вирусов FECV в FIPV, а также генетические различия между штаммами FIPV сильно затрудняют их дифференцировку.
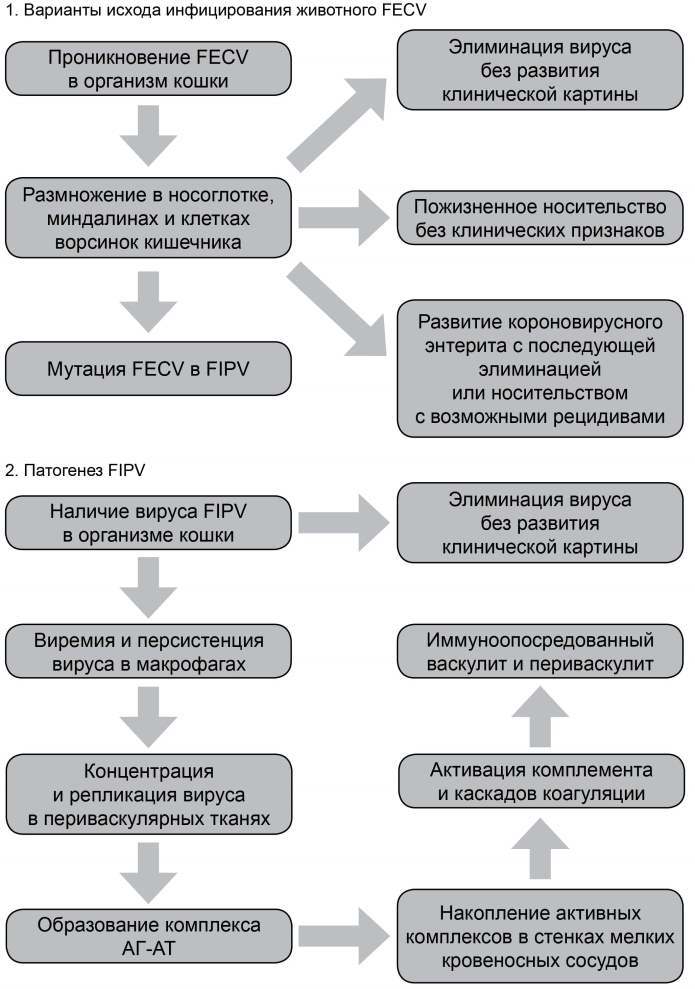
Рис. 1. Варианты развития коронавирусной инфекции кошек.
Определение титра антител к коронавирусам методом ИФА не является точным диагностическим тестом. Титр антител к корона-вирусам 1 : 800 - 1 : 1600 при исследовании ИФА может свидетельствовать о возможной инфицированности животного как вирусом инфекционного перитонита, так и вирусом коронавирусного энтерита и/или ксеногенными коронавирусами, а также указывать на латентную форму болезни или носительство. Животные с титром антител 1 : 800 - 1 : 3200 при ИФА исследовании должны считаться вирусоносителями. Диагностическим титром антител в ИФА считается титр 1 : 3200 и выше [3].
Однако, по результатам исследований датской ветеринарной школы, некоторые кошки в питомниках имеют стабильный титр антител 1 : 5000 - 1 : 8000 на протяжении многих лет, но при этом никогда не показывают картину инфекционного вирусного перитонита или коронавирусного энтерита.
При определении титра антител методом ИФА важно учитывать динамику его изменений. Только при прогрессирующем росте (например, при росте от 1 : 250 до 1 : 4000 через 2-3 недели) и клинической картине может быть поставлен диагноз «инфекционный перитонит» [3].
Для диагностики инфекционного перитонита кошек могут быть использованы: метод флюоресцирующих антител, для неспецифической экспресс-диагностики - йодно-агглютинационный тест и проба Ривалта. В настоящее время проводится специфическая ПЦР-диагностика на FIPV, но ее эффективность еще полностью не доказана [3].
Посмертное гистопатологическое исследование пораженных тканей - это наиболее точный метод, позволяющий поставить окончательный диагноз инфекционного пе-ритонита.
Для практикующих ветеринарных врачей важно помнить, что выявление FECV (особенно в кале) и/или высокий титр антител к коронавирусам в крови не может быть причиной для установления диагноза инфекционного вирусного перитонита кошек!
Патологоанатомические изменения
Кошки, павшие от инфекционного перитонита, обычно истощены. Слизистые оболочки иктеричны (рис. 2).
Выражен асцит. В брюшной полости может скапливаться до 1 литра экссудата. Жидкость обычно почти прозрачная, может содержать хлопья фибрина, различных оттенков желтого цвета, опалесцирующая, вязкая (рис. 3).
Серозные оболочки внутренних органов тусклые, покрыты фибрином в виде наложений различной формы и размера (рис. 3).
На серозных покровах также встречаются белые очажки некроза, а также массы плотного экссудата в виде мелких бляшек и узелков размером 2-10 мм, проникающих в органы: печень, стенку кишечника и другие (рис. 4-6).
В плевральных полостях экссудата обычно меньше, чем в брюшной полости. Под плеврой могут быть обнаружены фибриновые отложения и очажки некроза (рис. 7). Легкие обычно уплотнены, темно-красного цвета.
В некоторых случаях диагностируют скопление экссудата в перикарде, серозный перикардит. Лимфатические узлы брюшной и грудной полостей увеличены. На разрезе хорошо выражен их рисунок. У животных с пролиферативной формой инфекционного перитонита обнаруживают воспалительные очаги в различных органах грудной и брюшной полостей, в центральной нервной системе, глазах [1, 8].
Лечение
Специфического лечения инфекционного вирусного перитонита кошек не существует. Лечение симптоматическое и может носить только поддерживающий характер. По некоторым данным жизнь животного может быть продлена на несколько месяцев при применении комплекса кортикостероидов, противовирусных и иммуносупрессирующих препаратов [8].
Вакцинация
На рынке представлена единственна вакцина против инфекционного вирусного перитонита кошек Примуцел FIP, состоящая из аттенуированного вируса перитонита кошек (штамм DF2-FIPV) и гентамицина в качестве консерванта. По данным производителя, штамм DF2-FIPV интенсивно реплицируется при температуре 31 °С (температуре тканей поверхности дыхательных путей)
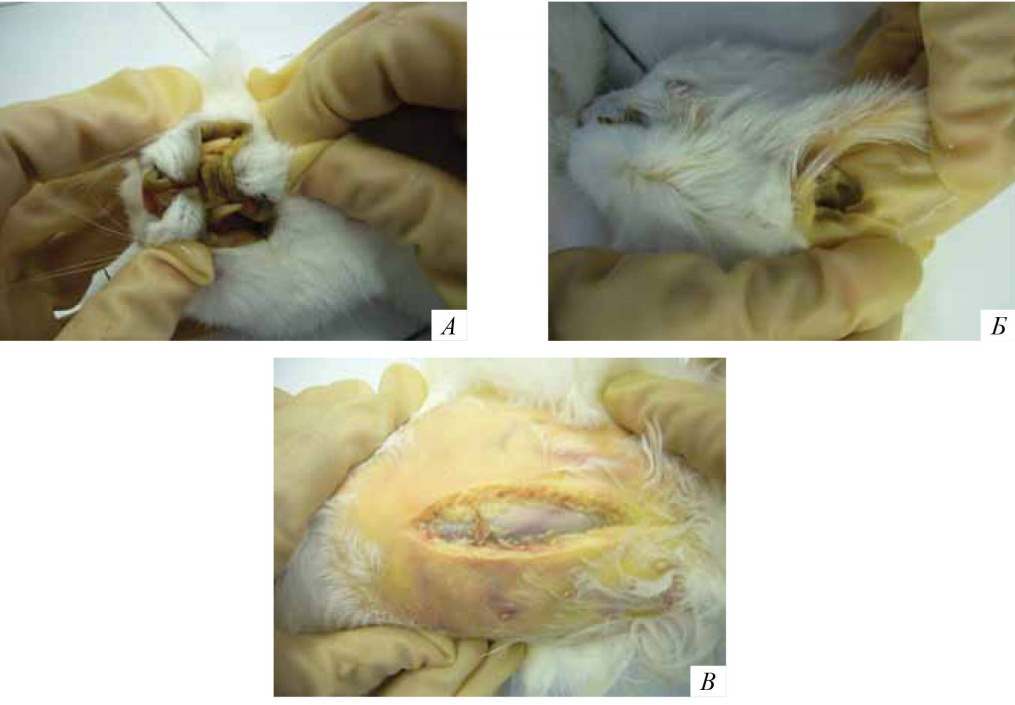
Рис. 2. Инфекционный вирусный перитонит кошек. Выпотная форма. Ярко выраженная иктеричность кожи (А), слизистой (Б), подкожно-жировой клетчатки [4].
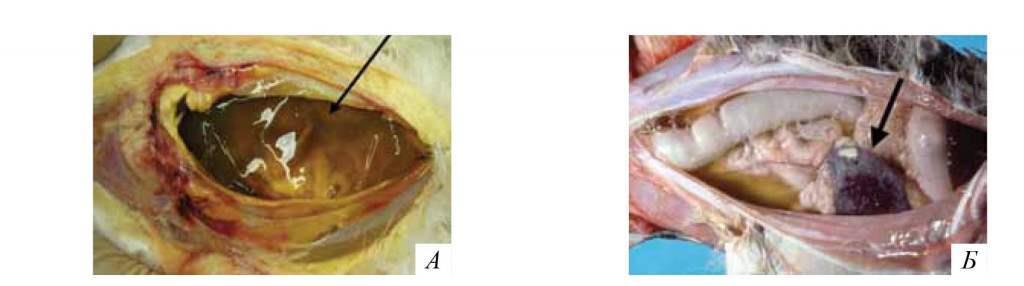
Рис. 3. Инфекционный вирусный перитонит. Выпотная форма. Брюшная полость кошки. Асцит и спаечный процесс сальника (Б) [4, 5].
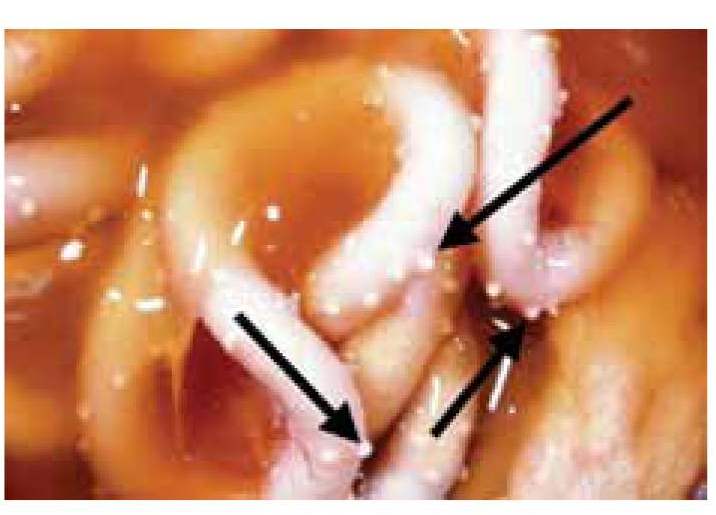
Рис. 4. Инфекционный вирусный перитонит. Выпотная форма. Асцит брюшной полости и отложения фибрина на кишечнике при инфекционном вирусном перитоните [по 5].
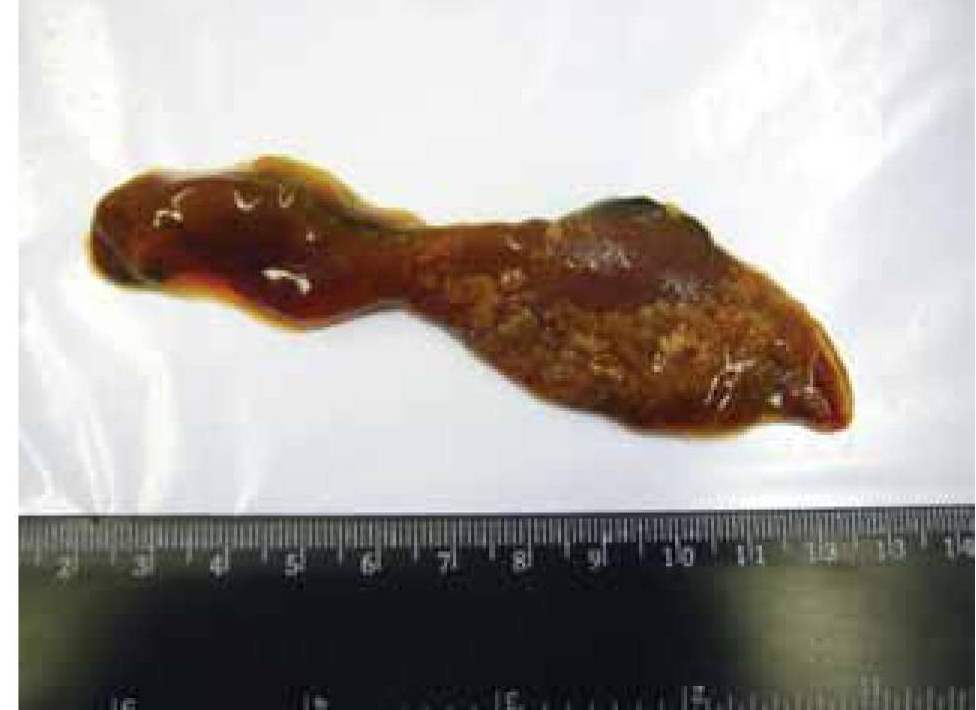
Рис. 5. Инфекционный вирусный перитонит кошек. Выпотная форма. Спленомегалия. Множественные милиарные очаги и отложение пленок фибрина на селезенке [4].
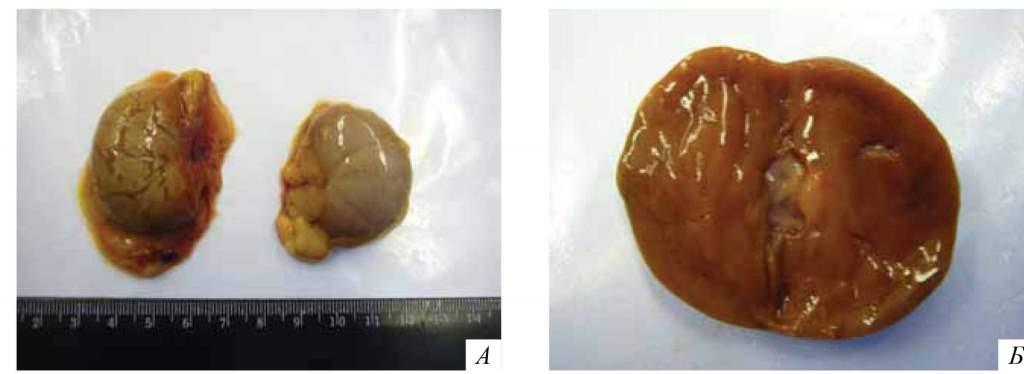
Рис. 6. Инфекционный вирусный перитонит кошек. Выпотная форма. Почка с признаками некротического нефрита с застойными явлениями [4].
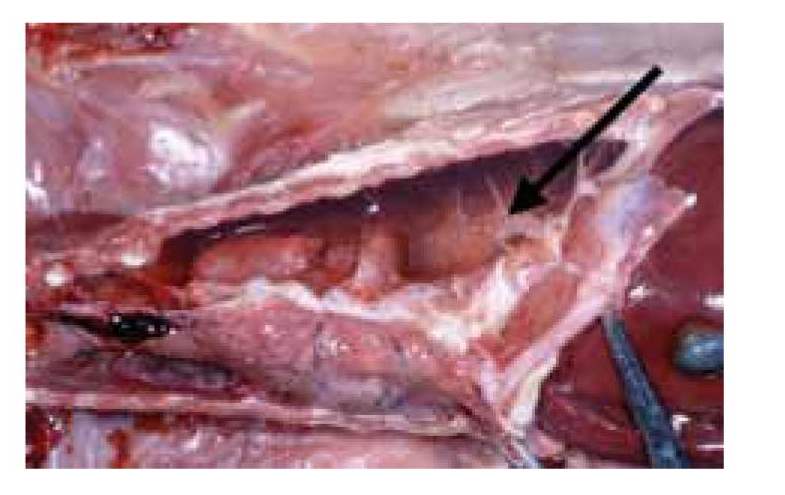
Рис. 7. Выпот в грудную полость и серозно-фибринозный плеврит [ по 5].
перитонита кошек Примуцел FIP, состоящая из аттенуированного вируса перитонита кошек (штамм DF2-FIPV) и гентамицина в качестве консерванта. По данным производителя, штамм DF2-FIPV интенсивно реплицируется при температуре 31 °С (температуре тканей поверхности дыхательных путей) и не размножается при температуре тела животного (39 °С). Вакцина вводится интраназально в дозировке 0,5 мл. Примуцел FIP вызывает формирование иммунного ответа через 4 недели после двукратного введения, продолжительностью не менее 12 месяцев. Но зачастую вакцинация не дает ожидаемого результата. Поствакцинальнй иммунитет имеет слабую напряженность. Вакцинированные кошки становятся устойчивыми только к небольшим дозам вируса. При более высоких дозах вируса вакцинированные животные зачастую показывают менее выраженную клиническую картину может наступать стадия ремиссии, но у всех исследованных кошек летальный исход наступил в течение 2 лет [8].
К тому же в литературе описан феномен антителозависимого усиления инфекции (antibody-dependent enhancement, ADE). Суть феномена состоит в усилении инфекционного процесса в присутствии антител, специфических к возбудителю инфекционной болезни. ADE развивается в две стадии: внешнее ADE - вирусспецифические анти-тела, образовавшие комплекс с вирусом по-средством взаимодействия Fc-фрагментов с Fc-рецепторами (FcR) и/или с рецепторами комплемента на поверхности фагоцитирующих клеток, усиливает проникновение вируса в чувствительные клетки; внутреннее ADE - комплексы вирус - антитела, взаимо-действуя с фагоцитирующий клетками через Fc-рецепторы и рецепторы комплемента, запускают сигнальные механизмы, блокирующие ее антивирусную защиту, и тем самым способствуют внутриклеточному размножению вируса.
В случае с FIP феномен антителозависимого усиления инфекции доказан как в условиях in vitro, так и на живом организме [2].
Список литературы
1. Старченков, С. В. Заразные болезни собак и кошек / Старченков С. В. - СПб. : СПС, 2001. - 368 с.
2. Супотницкий, М. Феномен антителозависимого усиления инфекции у вакцинированных и переболевших / М. Супотницкий, А. Миронов, Е. Лебединская // Биопрепараты. -№ 3. - 2013. - С. 12-25.
3. Терехова, Ю. О. Выявление антител к вирусу инфекционного перитонита кошек (ИПК) иммуноферментным методом / Ю. О. Терехова, Н. А. Рахманина // Российский ветеринарный журнал. Мелкие домашние и дикие животные. - № 1. - 2012. - С. 24-28.
4. Фотоархив Российского университета дружбы народов. Аграрный факультет, кафедра морфологии животных и ветеринарно-санитарной экспертизы.
5. Jakowski R., DVM, PhD, DACVP. Фотографии. Tufts University, 2012.
6. Pedersen, N. С. Feline infectious peritonitis: Newer findings from around the world / N. С Pedersen // Center for Companion Animal Health, School of Veterinary Medicine, University of California, 2011. - P. 11.
7. Pedersen, N. С A synopsis of feline infectious peritonitis virus infection// Center for Companion Animal Health, School of Veterinary Medicine, University of California, 2010. -P. 47.
8. Pedersen, N. С A review of feline infectious peritonitis virus infection: 1963—2008 /N. С Pedersen// Journal of Feline Medicine and Surgery, 2009. - P. 82.
9. Stephenson, N. Feline infectious peritonitis in a mountain lion (Puma concolor) / N. Stephenson, P. Swift, R. B. Moeller, S. J. Worth, J. Foley // J. Wildl Dis.-USA, California.-2013.-P. 12.



