О.А. Зейналов, В.А. Андрюшина, Д.А. Авданина,
Центр «Биоинженерия» РАН (Москва)
Сокращения: МТ — масса тела; ПГ — прогестерон
Введение
Среди многочисленных лекарственных средств, применяемых в медицине и ветеринарии, особое значение имеют прогестины (гестагены). Спектр их использования чрезвычайно велик. В медицине показаниями к их назначению служат: недостаточность лютеиновой фазы менструального цикла и другие прогестерондефицитные состояния, гиперплазия эндометрия, угроза прерывания беременности, а также гормонозависимые опухоли [1]. В ветеринарии гестагены также часто используют, прежде всего с лечебной целью (при нарушениях функции яичников, матки, расстройствах гипоталамо-гипофизарной системы, для поддержания беременности, предупреждения эмбриональной смертности, коррекции сроков родов и др.). Кроме того, с их помощью регулируют отдельные этапы воспроизводства животных [2]. В последнем случае используют свойство прогестагенов тормозить половую охоту и овуляцию, что позволяет у сельскохозяйственных животных синхронизировать половые циклы, а у собак и кошек — подавлять течку и охоту или смещать сроки их наступления. Благодаря синхронизации половых циклов гестагенами удается вызвать охоту у большей части коров в 7-дневный период, достичь высокой оплодотворяемости, значительно сократить сервис-период и, как следствие, повысить выход телят и молочную продуктивность [3]. Коррекция половой функции домашних животных, в частности кошек и собак, остается важной ветеринарной проблемой. Прежде всего необходимо устранить у животных клинические проявления либидо в период пустовки собак и на стадии эструса кошек, свидетельствующих о готовности животных к спариванию и доставляющих немало хлопот их хозяевам. В этот период животные становятся агрессивными, плохо едят, издают пронзительные крики, часто убегают из дома. Много хлопот доставляют ложная щенность и заболевания, передающиеся половым путем. Решить эти проблемы можно двумя способами: гормональной коррекцией или стерилизацией. В обоих случаях изменяется метаболизм организма. Однако преимущество гормонального воздействия — его обратимость, в то время как стерилизация приводит к необратимой потере репродуктивной функции и отрицательно влияет на физиологические процессы до конца жизни.
В мировой ветеринарной практике воспроизводительную функцию животных регулируют синтетическими производными 17а-гидроксипрогестерона, например его капронатом, мегестрола ацетатом, медроксипрогестерона ацетатом, пролигестоном [2]. Эти соединения либо сами по себе, либо в сочетании с эстрогенами или простагландинами стимулируют охоту у животных и повышают синхронность ее проявления, нормализуют гипер- и гипофункцию яичников, а также снижают половую активность особей обоего пола, при этом подавление полового цикла носит обратимый характер. В настоящее время существует много препаратов, созданных на основе этих соединений в разных странах и в разное время. К сожалению, они далеки от совершенства. Общим достоинством синтетических аналогов является то, что они как простейшие модификации природных прогестагенов и их метаболитов находятся в тесном родстве с ними, поэтому достаточно безвредны и при наличии высокой активности и отсутствии побочных эффектов могут быть использованы в качестве лекарственных средств. Общий недостаток большинства указанных соединений — кратковременность действия (кроме пролигестона) и необходимость в достаточно больших дозах и длительном курсе применения (5...10 дней до получения эффекта), что может вызвать побочные эффекты, в том числе метропатии. Например, медроксипрогестерона ацетат дают животным по 2...3 мг/кг МТ, а доза мегестрола ацетата при регуляции половой охоты составляет 35...40 мг (7...8 дней по 5 мг) для животных МТ до 5 кг. Использование одного гестагена в столь значительных количествах далеко не безопасно и может привести к гормональным нарушениям.
Особое место в ряду ветеринарных препаратов занимает пролигестон (дельвостерон) — один из лучших препаратов на сегодняшний день. Благодаря оригинальной структуре действующего вещества (наличие в его молекуле 14а-, 17а-пропилидендиокси-группы) препарат депонируется в жировой клетчатке и оказывает стойкий и пролонгированный (5...6 мес) эффект на репродуктивную систему. Пролигестон быстро снимает агрессивность и гиперсексуальность, улучшает аппетит и способствует увеличению МТ животного. Его используют для лечения и профилактики ложной щенности и дерматитов. Однако этот препарат трудно синтезировать и он дорог. К его недостаткам можно отнести необходимость использования в виде инъекций. Таким образом, поиск соединений, обладающих высокой активностью, пролонгированным действием и лишенных побочных эффектов, остается актуальной задачей.
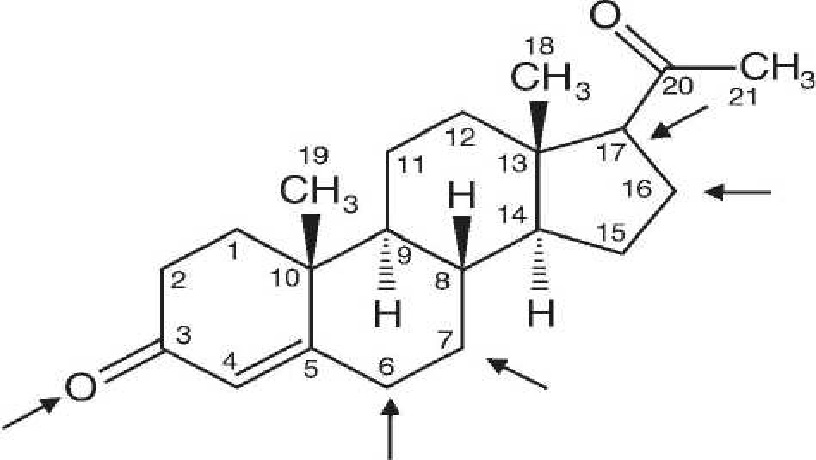
Рис. 1. Прогестерон
Гормоны относят к веществам «однократного действия» [4]: проявив свои биологические свойства, они дезактивируются в организме, превращаясь в метаболиты. Изменение молекулярной структуры гормона может увеличить время его метаболизма, в течение которого гормон будет выполнять свою функцию. В соответствии с известным механизмом действия прогестерона легко определить пути модификации, которая обеспечит блокаду основных центров метаболизма молекулы и продлит ее биологическое действие в организме [5]. Химическая защита молекулы гормона метильной группой или галоидом при С6 или дополнительное введение А 6-двойной связи затрудняет его метаболизм по 6-му положению, а
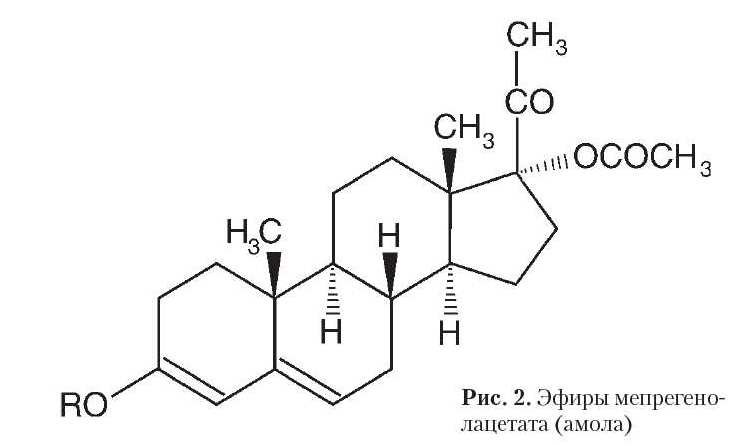
Рис. 2. Эфиры мепрегено-лацетата (амола)
введение заместителя в 17а-положение и удаление кислорода при С3, например путем присоединения оксиацильной группы, затрудняет метаболизм по 3-му и 17-му положениям стероидной молекулы. Именно такие изменения претерпела молекула прогестерона при переходе к производным мепрегенола: блокированы все основные центры метаболизма путем введения А 6-двойной связи, метильной группы при С6, оксиацильной группы при С17 и восстановлением кетогруп-пы при С3. Благодаря структурной модификации возникает возможность найти в ряду производных мепрегенолацетата соединения, превосходящие по своим фармакологическим свойствам природный прогестерон. Пути модификации молекулы прогестерона в соответствии с механизмом его действия представлены на рисунке 1.
Из литературных источников известно [6, 7], что пролонгации действия стероидных соединений можно достичь применением их сложных эфиров, содержащих гидроксильные группы чаще всего при С3, С17 и С21. Эфиризация стероидных препаратов замедляет выделение соответствующих гормонов в организме по мере гидролиза их эфирных групп, что обеспечивает длительное существование базового вещества в организме и пролонгацию его терапевтического действия. Поэтому сложные эфиры стероидных спиртов широко применяют в качестве лекарственных препаратов пролонгированного действия. Например, однократная инъекция лекарственного препарата тетрастерона, состоящего из четырех входящих в его состав эфиров тестостерона (пропионата, фенилпропионата, изокапроната и капроната), оказывает лечебный эффект в течение месяца [8]. Это достигается неодновременным гидролизом входящих в его состав эфиров.
Цель исследования
Целью исследования был поиск новых высокоактивных аналогов в ряду эфиров мепрегенолацетата для их дальнейшего применения животным.
Материалы и методы
Разработанный нами синтез сложных эфиров мепрегенолацетата из стеринов растительного и животного происхождения (фитостерины, холестерин) [9,10,11,] сделал их достаточно доступными. Синтезированы новые соединения (рис. 2, табл. 1), имеющие нормальное и изостроение эфирного заместителя при С3, а также с заместителями, содержащими ароматические кольца [12, 13, 14].
Затем изучили их гестагенную и контрацептивную активности.
Гестагенную активность полученных соединений и природного прогестерона сравнивали методом Clauberg-McPhail на неполовозрелых кроликах-самках, а их контрацептивную активность в сочетании с этинилэстрадиолом — на половозрелых белых крысах линии Вистар (исследования проведены в НИИАГ им. Д.О. Отта РАМН, Санкт-Петербург).
Самкам кроликов, которым предварительно давали эстрогены, в течение 5 дней ежедневно вводили испытуемые препараты в определенном диапазоне доз (5 доз; 5 кроликов на 1 дозу).
Прогестерон инъецировали в виде масляного раствора. Подопытным животным растворы испытуемых соединений, приготовленные на растительном масле, ежедневно в утренние часы вводили в желудок через зонд. На следующий день после завершающего введения препарата кроликов подвергали эвтаназии. При вскрытии фрагмент одного рога матки брали для гистологического анализа. Тонкие срезы органа (7 мкм) исследовали на светооптическом уровне при увеличении х 12. Гестагенную активность оценивали по 4-балльной шкале McPhail, принимая во внимание степень прегравидных изменений эндометрия. Из каждого фрагмента матки исследовали по несколько срезов. Результаты опытов обрабатывали методом регрессионного анализа. Регрессию вычисляли по формуле
у = а + big х,
где у — индекс McPhail; а и b — коэффициенты регрессии; х — доза гестагена в мг/кг МТ.
Биологическую активность соединений оценивали по ЕД50, соответствующей индексу McPhail, равному 2.
Относительную гестагенную активность вычисляли, принимая за единицу активность прогестерона.
Контрацептивную активность изучали стандартным методом: вводили препараты (гестаген в сочетании с эстрогеном в соотношении 0,8 и 0,04 мг/кг МТ соответственно) в течение 14 дней. На третий день самок подсаживали к самцам. Ежедневно цитологическим методом исследовали влагалищные мазки. День обнаружения спермиев в мазке считали первым днем беременности. Покрытых самок отсаживали в отдельные клетки и завершали 14-дневный курс введения испытуемых препаратов. В течение 20 дней у покрытых самок продолжали брать мазки, чтобы определить, сохранилась или прервалась беременность. На 20...21-й день после покрытия всех животных подвергли эвтаназии. При вскрытии определяли наличие плодов и мест имплантаций в матке. Контрацептивную активность (КА) рассчитывали по формуле, %:
КА(%) = (1- Бо Ч Пк/По Ч Бк) Ч 100,
где Бо и Бк — число беременных крыс в опыте и контроле соответственно; По и Пк — число покрытых крыс в опыте и контроле соответственно.
Для покрытия использовали по два самца на трех самок (спариваемых животных содержали совместно в течение 4 дней).
Результаты и обсуждение
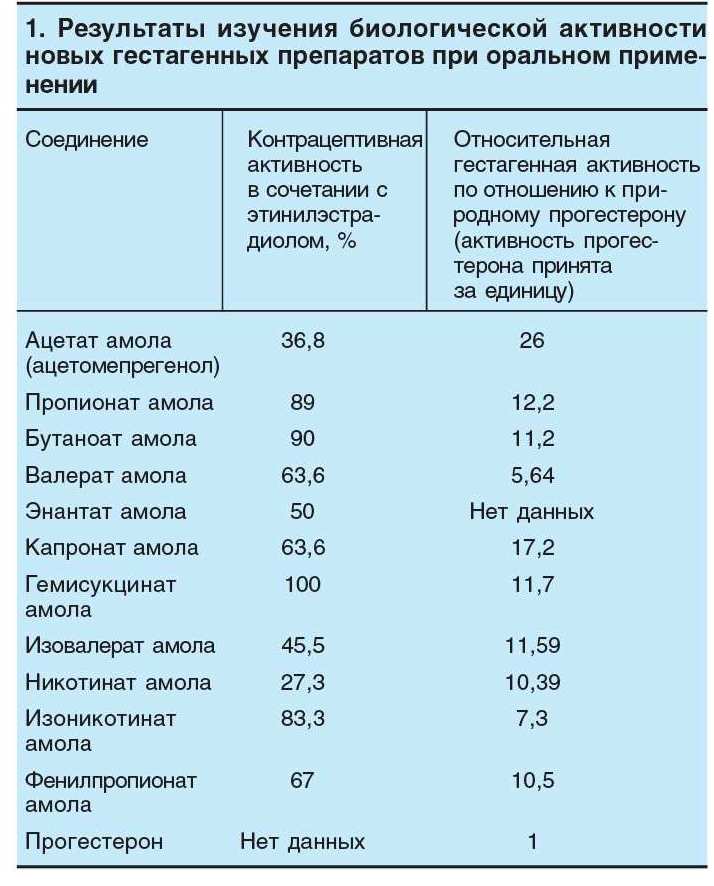
Средний уровень биологической активности новых гестагенных препаратов приведен в таблице 1.
У синтезированных эфиров гестагенная активность оказалась более высокой, чем у природного прогестерона, а в комбинации с этинилэстрадиолом все эфиры проявили выраженный контрацептивный эффект. Как видно из таблицы 1, как гестагенная, так и контрацептивная активности у изученных эфиров значительно различаются. Можно сделать вывод о зависимости биологической активности от устойчивости эфирной связи к гидролизу, определяющейся характером заместителя при С3. Чем медленнее гидролизуется эфирная группа, тем выше гестагенная активность соединения. В ряду эфиров мепрегенола ацетата нет прямой зависимости между гестагенной активностью и контрацептивным эффектом. Напротив, у многих эфиров с высокой гестагенной активностью выявлен низкий контрацептивный эффект, и наоборот. Например, контрацептивный эффект наиболее активного гестагена — диацетата мепрегенола (относи-

тельная гестагенная активность 26) в сочетании с этинилэстрадиолом составляет 36,8 %, в то время как пропионат и изоникотинат амола при низкой гестагенной активности (12,2 и 7,3 соответственно) проявляют высокий контрацептивный эффект (89 % и 83,3 % соответственно). Это может быть связано с наличием у некоторых соединений сопутствующей активности (например, антигонадотропной или антиандрогенной), способной повлиять на величину контрацептивного эффекта. Несовпадение в стероидных эфирах высокой гестагенной активности с величиной контрацептивного эффекта ранее отмечали у других производных 17ос-оксипрогестерона [15,16]. Эти авторы предположили, что механизм действия таких гестагенов определяется не торможением овуляции, а влиянием на постовуляторные процессы. Такое разобщение биологических свойств гестагенных препаратов изученного ряда может позволить использовать соединения с высоким гестагенным индексом в качестве лечебных средств в медицине и ветеринарии, а другие — в качестве высокоактивных контрацептивных препаратов со сравнительно низким гестагенным действием.
В экспериментах на кошках и собаках выявили, что под влиянием эфиров мепрегенола улучшается физическое состояние животных, снижаются половое возбуждение и агрессивность[12]. На фоне введения эфиров с 1-го по 3-й день (в зависимости от вида и МТ животных) быстро снимались признаки половой охоты и наступало успокоение. Процент контрацепции у вошедших в контакт животных был высоким. Результаты опытов приведены в таблице 2.
Таким образом, исследованный ряд сложных эфиров мепрегенолацетата можно условно разделить на две группы соединений: с высокой гестагенной активностью и высокой контрацептивной активностью. Обе группы соединений представляют большой интерес как основа для лекарственных препаратов нового поколения. Основные достоинства соединений этого ряда — их высокая активность при пероральном использовании (разовая доза составляет от 0,001 до 0,1 мг/кг МТ животного), отсутствие побочных андрогенного и эстрогенного эффектов, свойственных гестагенам 19-норстероидного ряда, и полное отсутствие как специфической (аллергенность, мутагенность, тератогенность), так и острой токсичности (LD25 значительно превышает дозу 2 тыс. мг/кг МТ).
Выводы
На основе полученных результатов можно сделать следующие выводы.
1. Среди изученного ряда эфиров мепрегенола ацетата найдены высокоактивные гестагены и соединения с высоким контрацептивным эффектом, представляющие интерес для медицины и ветеринарии.
2. Результаты проведенных нами исследований по изучению биологической активности новых гестагенных препаратов свидетельствуют о перспективности их применения в области ветеринарии для решения практически важной проблемы — регуляции воспроизводства животных.
БИБЛИОГРАФИЯ
1. Машковский М.Д. Лекарственные средства. М, 1993. Т. 1. С. 690.
2. Карпов В.А. Акушерство и гинекология мелких домашних животных. М.,1990. С. 268-270.
3. Прокофьев М.И., Кадатский Г.М., Сабиров Т.К. Регуляция воспроизводительной функции у коров прогестагенами // Зоотехния. 1994. № 2. С. 21—24.
4. Ахрем А.А., Титов Ю.А. Кортикостероиды // Природа. 1966. № 10. С. 40.
5. Гриненко Г.С., Клинский Ю.Д., Кадатский Г. М. и соавт. Изучение новых прогестагенных препаратов для регуляции половой функции сельскохозяйственных животных. Гормональное животноводство. 1977. С. 146—161.
6. Шахтмейстер И.Я. Проблемы рационального использования наружных лекарственных средств глюкокортикоидной природы в педиатрической практике, http:medi.ru/doc/6590110.htm
7. Машковский М.Д. Лекарственные средства. М, 1993. Т. 1. С.704—705.
8. Машковский М.Д. Лекарственные средства. М.: Медицина, 1993. Т. 1. С. 694.
9. Андрюшина В.А., Савинова Т.С, Скрябин К.Г. Способ получения прегнанов. Пат. РФ № 2156255. Бюл. изобрет. № 26. 2000.
10. Андрюшина В.А., Савинова Т.С, Скрябин К.Г. Способ получения стероидных эфиров: Пат. РФ № 2091388, Бюл. изобрет. № 27. 2000.
11. Андрюшина В. А., Савинова Т.С., Гриненко Г. С. Контрацептивное средство для животных и способ его получения. Пат. РФ № 2091019, Бюл. изобрет. № 27.1997.
12. Андрюшина В.А., Савинова Т.С, Скрябин К.Г. и соавт. Универсальное средство для ингибирования репродукции позвоночных животных: Пат. РФ № 2101013, Бюл. изобрет. № 1. 1998.
13. Зейналов О.А., Андрюшина В.А., Скрябин К.Г. Средство для регуляции репродуктивной функции и половой активности позвоночных животных и способ регуляции репродуктивной функции и половой активности позвоночных животных: Пат. РФ № 2233586, Бюл. изобрет. № 22. 2002.
14. Зейналов О.А., Андрюшина В.А., Савинова Т.С. и соавт. Эфиры мепрегенола ацетата: синтез и оценка биологического действия. Вопросы биологической медицинской и фармацевтической химии, 2004. № 2. С. 8—11
15. Никитина Г.В., Савченко О.Н., Степанов М.Г. Гормональные свойства новых производных 17а-оксипрогестерона. Проблемы эндокринологии. 1987. № 3. С. 60-63.
16. Neuman F., Elger W., Nishino I., Steinbeck H. Arzneim. Forsch. Dnig res., 1977. №27. С 296-318.
РВЖ МДЖ №1-2005



