Роман Леонард, президент Российской научно-практической ассоциации ветеринарных нефрологов и урологов (www.vetnefro.ru), руководитель Уральского центра ветеринарной нефрологии и урологии, г. Челябинск. E-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
|
Основные положения 1. В норме почечный фильтр, представляющий собой стенку капилляра, благодаря структуре и заряду его слоев непроницаем для подавляющего большинства белков плазмы крови и связанных с ним веществ. А некоторые низкомолекулярные белки, все же попавшие в первичную мочу, практически на сто процентов реабсорбируются эпителием проксимальных канальцев. 2. Количественное и качественное определение уровня протеинурии является обязательным этапом исследования мочи в частности и комплексного нефрологического обследования в целом, имеющим важное диагностическое значение, поскольку оно является не только наиболее ранним маркером заболевания почек, но и важным фактором в прогрессировании нефропатий как гломерулярного, так и тубулоинтерстициального ряда. 3. На протеинурию должны регулярно обследоваться все клинически здоровые кошки старше б-месячного возраста и собаки старше 5—7 лет, а также все животные вне зависимости от возраста, перенесшие заболевания, особенностью этиопатогенеза которых является прямое или опосредованное поражение почек. 4. Выделяют собственно ренальную протеинурию, а также пре- и постренальную. 5. Определение типа ренальной протеинурии может помочь в диагностике имеющейся у пациента нефропатий, определиться с прогнозом заболевания и стратегией последующего органопротективного лечения. 6. При выявлении протеинурии необходимо оценить возможные сопутствующие осложнения, особенно уровень азотемии, гипоальбуминурии, гиперпаратиреоза, гипертонии и изменений на глазном дне. Протеинурия напрямую коррелирует не только со степенью тяжести большинства нефропатий и со сроками появления азотемии, гиперпаратиреоза, но и с уровнем выживаемости пациентов (периодом дожития). |
В статье использованы фото автора.
Введение
Протеинурия как обобщённое понятие означает появление в моче любых белков в количестве, превышающем физиологическую норму. Однако этот термин в большинстве клинических случаев требует конкретизации, поскольку важное диагностическое и прогностическое значение может иметь не только количественный, но и качественный белковый состав мочи (т.е. преобладание в ней тех или иных белковых фракций).
В данной статье под гиперпротеинурией, или неселективной протеинурией, понимаются патологические состояния, при которых в моче присутствуют альбумины и глобулины в количестве, превышающем 0,30 г/л, т.е. в таком, когда они могут быть обнаружены при помощи методов сухой химии (мочевые тест-полоски). А под альбуминурией, или селективной протеинурией, описываются физиологические или патологические состояния, при которых в моче выявляются лишь мелкие белковые молекулы-альбумины в количестве, не превышающем 0,30 г/л (т.е. в объёме, недоступном для верификации мочевыми тест-полосками).
Также следует учитывать, что протеинурия может носить как ренальный, так и пре- и постренальный характер. Постренальную протеинурию в некоторых случаях (например, при заболеваниях уретры и половых органов) можно дифференцировать путём забора мочи чрезбрюшинным уроцистоцентезом. Для исключения преренальной протеинурии обычно требуется проведение ряда диагностических мероприятий.
В то же время альбуминурия всегда имеет сугубо ренальные причины, связанные с нарушениями в гломерулярном и/или тубулярном аппарате почки.
Типы ренальной протеинурии у собак и кошек
В конечную мочу здоровых животных попадает очень небольшой объём белковых молекул, поскольку неизмененный гломерулярный фильтр в силу анатомического строения и отрицательного заряда своих структур для них непроницаем (исключение составляют полипептиды, имеющие молекулярную массу меньше 20 кДа). Однако низкомолекулярные белки, по каким-либо причинам все же попавшие в первичную мочу, моментально и на 95-99% реабсорбируются в проксимальных канальцах.
Тем не менее во вторичной моче и у здоровых животных всё-таки может присутствовать незначительное количество низкомолекулярных белков, таких как альбумины, трансферрин, фрагменты иммуноглобулинов, а также и некоторых других типов протеинов, синтезируемых, например, канальцевым эпителием в процессе своей жизнедеятельности. Например, мукопротеин Тамма-Хорсфалля, также называемый уромодулином. Белок Тамма-Хорсфалля секретируется эпителиальными клетками петли Генле и имеет важное клиническое значение, поскольку из него формируется матрикс большинства мочевых цилиндров. Поэтому содержание в моче альбуминов и незначительного объёма других белковых молекул в количестве, не превышающем 0,010 г/л, является физиологической нормой и называется нормомикроальбуминурией. Однако некоторые авторы указывают на то, что эти нормы завышены, поскольку не учитывают компенсаторное увеличение реабсорбции белка в канальцах, развивающееся в ответ на их избыточную экскрецию (т.е. повреждение фильтрационного барьера гломерулы уже существует, но зафиксировано оно при исследовании мочи быть не может из-за компенсаторных процессов в канальцевом аппарате).
При некоторых состояниях, таких, например, как стресс, повышенные физические нагрузки, белковый перекорм, гипертермия (лихорадка) или переохлаждение, а также после грубой пальпации почек (особенно у кошек) количество альбуминов в моче может увеличиваться до уровня 0,01 —0,3 г/л (т.е. развивается микроальбуминурия). Причём, как отмечает ряд авторов, микроальбуминурия, развивающаяся на фоне стресса, чаще оказывается более выраженной, чем возникающая при интенсивной физической активности или белковом перекорме. Но если эти изменения, обычно связанные с замедлением почечного кровотока и/или некоторым увеличением проницаемости почечного фильтра, носят транзиторный (эпизодический) характер, то они могут рассматриваться как вариант физиологической нормы.
В то же время постоянное выделение почками белка в количестве, превышающем обычный физиологический минимум (>0,01 г/л) — микроальбуминурия и особенно гиперпротеинурия (> 0,3 г/л), — всегда является не только маркером их повреждения, но и одним из значимых факторов в этиопатогенезе нефропатий.
Однако следует принять во внимание, что до какого-то момента увеличение проницаемости фильтрационного барьера для альбуминов может быть диагностировано только по косвенным признакам (например, по подоцитурии и/или дисбалансу между воспалительными и противовоспалительными факторами почки) из-за увеличения уровня компенсаторной реабсорбции профильтровавшихся белков. То есть нарушения возникают раньше, чем можно диагностировать микроальбуминурию даже путём проведения высокоточных исследований мочи.
Исходно уровень протеинурии у кошек, как правило, значительно выше, чем у собак. Это связано не столько с особенностями мочеобразования (моча домашних кошек, ведущих своё происхождение от полупустынных предков, имеет относительно высокую плотность — в пределах 1,035-1,045), сколько с большим количеством видоспецифичных для кошачьих хронически или латентно протекающих вирусных инфекций, постоянно дающих богатый «урожай» ЦИК ( Циркулирующие иммунные комплексы АТ+АГ+СГ), травмирующих почечный фильтрационный барьер и, следовательно, инициирующих развитие гломерулонефритов (особенностью течения большинства гломерулярных поражений у кошек, в частности хронического вирус-индуцированного гломерулонефрита, является то, что развиваются они на фоне постоянного прессинга со стороны первичного повреждающего фактора — вирусных АГ, что нехарактерно для большинства других типов гломерулонефритов (ГН)). Это обстоятельство является также и объяснением того, что гиперпротеинурия у кошек практически всегда сопровождается лейкоцитурией, хотя моча при этом стерильна (преобладающая субпопуляция клеток белой крови в мочевом осадке — агранулоциты, участвующие в почечной паренхиме в асептических воспалительных процессах). А стремительное вовлечённая при этом в патологический процесс тубулоинтерстиция достаточно быстро приводит ещё и к гипостенурии.
|
Поэтому на наличие протеинурии должны обследоваться все кошки старше 6-месячного возраста или даже раньше, если животное переболело какой-либо вирусной инфекцией. Переболевание кошками острыми или подострыми формами вирусных инфекций практически всегда приводит к развитию подострого гломерулонефрита, который из-за отсутствия у животных в большинстве случаев ярко выраженных клинических проявлений часто остаётся без внимания со стороны не только владельцев, но и ветеринарных врачей.С практической точки зрения микроальбуминурия может быть определена как повышенное содержание в моче альбуминов, ещё не определяемое мочевыми тест-полосками, но уже превышающее физиологическую норму, т.е. в пределах от 0,01 до 0,30 г/л. Для диагностики микроальбуминурии на сегодняшний день имеются не только сложные и/или дорогостоящие методики, для выполнения которых требуется хорошо оснащённая лаборатория и квалифицированный персонал, но и простые в использовании тест-полоски (подобные мочевым), предназначенные для выявления этого показателя в общеклинической практике именно у собак и кошек (например, Canine and Feline E.R.D. Renal Health Screen Tests, производимые фирмой Heska ( http://www.heska.com/Products/Renat-HeatthScreen/ERD-HeatthScreen.aspx)). Кроме того, разработаны и имеются в продаже в Европе и США тест-системы, позволяющие определять в произвольно взятой порции мочи соотношение «альбумин/креатинин мочи» и, следовательно, судить об уровне уже суточной альбуминурии. |
Таким образом, протеинурию можно разделить на три типа, имеющих различное диагностическое и прогностическое значение:
1) нормомикроальбуминурия (гипоальбуминурия), т.е. содержание в моче альбуминов, обусловленное чисто физиологическими причинами;
2) микроальбуминурия, или селективная протеинурия, — присутствие в моче мелких белковых молекул (альбумины, трансферрин, церулоплазмин и т.д.) в количестве, превышающем физиологическую норму, но ещё не определяемых мочевыми тест-полосками, т.е. в пределах от 0,01 до 0,30 г/л; этот тип протеинурии лишь в транзиторном варианте может рассматриваться как вариант физиологической нормы;
3) гиперпротеинурия, или неселективная протеинурия, — обнаружение в моче как низко-, так и высокомолекулярных белков (альбуминурия + глобулинурия + липопротеинурия и т.д. в количестве >0,30 г/л, что легко диагностируется с помощью методов сухой химии), развитие которой, согласно современным патофизиологическим представлениям, всегда связано с выраженным нарушением структурной целостности клубочкового фильтра и/или с каким-либо заболеванием (причём необязательно только мочевыделительной системы). Неселективная протеинурия всегда сопровождается присутствием в моче не только крупномолекулярных белков, но и низкомолекулярных (причём количество последних обычно даже превалирует), поскольку в дефекты фильтрационного барьера, доступные, например, для прохождения глобулинов, потоком хлынут и альбумины.
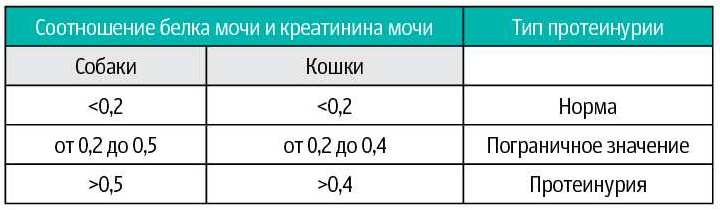
У животных уровень суточной протеинурии хорошо коррелирует с соотношением «белок/креатинин мочи». International Renal Interest Society (IRIS www.iris-kidney.com) подразделяет суточную протеинурию у собак и кошек, определяемую по соотношению «белок/креатинин мочи» на три типа: нормальный, пограничный и протеинурия (таблица 1).
Таблица 1. Соотношение «белок/креатинин мочи» (общий белок мг/мл: креатинин мг/мл) у собак и кошек по данным сайта www.iris-kidney.com
Выраженная клубочковая гиперпротеинурия (даже в изолированном варианте) может являться причиной развития таких угрожающих здоровью и жизни состояний, как, например, гипоальбуминемия, гиперлипопротеидемия и патологическое перераспределение жидкости в организме (гидроторакс, гидроперикард, отёки), то есть приводить к развитию нефротического синдрома. Кроме того, она служит одним из факторов, способствующих развитию коагулопатий и электролитного дисбаланса в организме у собак и кошек с нефропатиями, а также и иммунодефицитных состояний, поскольку наравне с другими белками организм интенсивно теряет такие важнейшие элементы гуморального иммунитета, как иммуноглобулины. Ослабление гуморального иммунитета, вызванного тяжёлой протеинурией, вкупе со стрессом, связанным с проведением различных лечебно-диагностических процедур, может являться причиной обострения латентных вирусных инфекций у кошек с нефропатиями.
Строение фильтрационного барьера почки
Фильтрационный барьер гломерулы представляет собой стенку артериального капилляра, имеющего особенное строение. Он легко проницаем для воды и растворённых в ней веществ, но непроницаем для клеток крови и подавляющего большинства белковых молекул.
Фильтрация первичной мочи, называемая ультрафильтрацией, представляет собой чисто механический процесс и не требует затрат энергии и кислорода. Это верно лишь отчасти, поскольку энергия и кислород на ультрафильтрацию всё же затрачиваются, но происходит это в миокарде, сокращения которого и создают необходимое для её осуществления кровяное давление. Движущей силой, выдавливающей до 1/5 жидкой части крови с растворёнными в ней веществами в мочевое пространство капсулы Боумена, является осмотическое давление, возникающее в результате разности диаметра приносящей (афферентной) артериолы и микрокапиллярных петель клубочка ( Эффективное фильтрационное давление в начале капиллярных петель клубочка составляет примерно Ю-18 мм рт. ст. (не путать с абсолютным давлением в капиллярных петлях, составляющем около 48 мм рт. ст.).) и выносящей (эфферентной) артериолы.
Строение фильтрационного барьера почки (клубочкового фильтра) имеет большое значение для понимания причин возникновения и прогрессирования протеинурии. Он состоит из трёх частей: эндотелиального и эпителиального слоев и расположенной между ними базальной мембраны. Нарушение структурной целостности каждого из слоев в отдельности или всех одновременно имеет ведущее значение в процессах развития протеинурии.
Гломерулярная базальная мембрана (ГБМ). Базальноп мембраной называют электронно-плотную бесклеточную структуру, связанную с базальноп плазматической мембраной эпителиальной клетки, но лежащую вне её. Базальные мембраны имеются не только в капиллярных петлях клубочка, но и во многих других тканях. Но лишь ГБМ обладают рядом фильтрационных свойств. Средний, несущий, слой представляет собой пластинку, сформировавшуюся путём слияния эндотелиальной и эпителиальной базальных мембран. ГБМ со стороны просвета капилляра покрыта фенестрированным эндотелием, а со стороны мочевого пространства — ножками второго и третьего порядка (или цитоподиями) эпителиальных клеток, называемых подоцитами.
ГБМ представляет собой непрерывную пластину (непрерывный тип базальных мембран) и дополнительно (помимо того, что служит частью фильтрационного барьера) является как бы скелетом для гломерулярного микрокапиллярного пучка, подвешенного на мезангии. Изучение этой структуры клубочка при помощи электронной микроскопии позволило выделить в ней три слоя: средний, более плотный (lamina densa, или тёмная пластинка), расположен между двумя более тонкими (lamina rara externa и interna; наружная и внутренняя светлые, или, дословно, разреженные пластинки). Средняя, тёмная, пластинка ГБМ состоит преимущественно из коллагена IV типа, нити которого образуют тонкую, но очень плотную сетчатую структуру, поры в которой имеют диаметр до 5-7 нм и не дают проникать в первичную мочу крупным белковым молекулам.
Более мелкие белковые молекулы (а они практически все несут на своей поверхности отрицательный заряд) не попадают в мочевое пространство благодаря тому, что светлые пластинки ГБМ, также имеющие «скелет» из коллагена, пронизаны сульфатированными протеогликанами (в частности, гепарансульфатпротеогликаном), формирующими и концентрирующими отрицательный биоэлектрический потенциал в направлении от просвета капилляра к также отрицательно заряженным щелевым диафрагмам, расположенным между ножками подоцитов. Т.о., все отрицательно заряженные полипептиды из плазмы крови, теоретически способные преодолеть размероселективность ГБМ (размер большинства альбуминов, например, приблизительно равен размерам пор в фильтрационном барьере, как шар — лузе), практически отталкиваются от неё благодаря идентичности зарядов.
Следует отметить, что гепарансульфат-протеогликаны могут являться источником антигенемии ГБМ и участвуют в иммуноопосредованном поражении гломерул, протекающем по антительному типу. При этой патологии аутоантитела начинают атаковать базальную мембрану собственных клубочков, принимая её за чужеродную структуру. Важно это потому, что этот тип гломерулонефритов, равно как и любой другой, обязательно осложняется гиперпротеинурией той или иной степени тяжести. На электронной микроскопии поражение ГБМ при антительном ГН характеризуется расслоением её слоев и ослаблением связи с эндотелием и эпителиальными клетками.
В состав светлых пластинок ГБМ также входит целый ряд других веществ, в частности, белок ламинин из семейства крупных адгезивных гликопротеинов. Благодаря этому веществу ГБМ очень плотно прикрепляется к эндотелиоцитам внутренней выстилки капилляров и клеточным стенкам подоцитов (за прочность скрепления ГБМ с эпителием отвечает также другой гликопротеин внеклеточного матрикса — фибронектин).
Фенестрированный эндотелий (ФЭ). Эндотелиоциты, имеющие уплощённую форму, плотным непрерывным монослоем покрывают внутреннюю, обращенную в просвет капилляра, поверхность ГБМ. Не менее 1/3 площади эндотелия капиллярных петель занимают локальные истончения — фенестры, или окошечки (отсюда и появилось его название фенестрированный) и поры, затянутые тончайшими мембранами. А в целом весь ФЭ покрыт слоем гликокаликса, сформированного по большей части молекулами протеогликанов.
ФЭ не только служит одним из фильтрационных слоев, но и является важной частью всего эндотелиального дерева как почек, так и организма в целом, принимающего самое активное участие в процессах гемостаза и регулирования тонуса сосудов (уровня кровяного давления). Общая масса эндотелия взрослого человека может достигать2 кг. Т.о., эндотелий в целом является самой крупной железой внутренней секреции организма. Поэтому повреждение ФЭ, какую бы этиологию оно ни носило, приводит к весьма схожим результатам: исключению части фильтрационного барьера из процессов мочеобразования и целому ряду других, как правило, необратимых, патологических изменений в почечной паренхиме, среди которых особо можно выделить гиперактивацию ренин-ангиотензин-альдостероновой системы (РААС) и инициацию и поддержание процессов фатальной репарации в капиллярных петлях клубочка. Неизбежным финалом перечисленных процессов является гломеруло- и нефросклероз.
Разумеется, что эндотелиальной дисфункции принадлежит ведущая роль в патогенезе большинства острых и хронических гломерулонефритов (ГН). Она также может являться одной из причин развития артериальной гипертензии при нефропатиях (хотя далеко не единственной), поскольку различные гемостатические и вазопрессорные вещества, интенсивно продуцируемые повреждённым фенестрированным эндотелием (а вовлечённым в хронически протекающий патологический процесс при ГН оказывается большой объём «эндотелиального дерева» почки), могут иметь и системное действие. Эндотелий сосудов на полном основании может быть назван железой внутренней секреции, поскольку продуцирует большое количество биологически активных веществ (например, эндотелиин, обладающий в 10 раз более сильными вазоконстрикционными свойствами, чем ангиотензин II). А почки — это один из органов, содержащих наибольшее количество эндотелиальной ткани в организме (в перерасчете на 1 грамм своего веса).
Висцеральные эпителиальные клетки (подоциты). С гистоморфологической точки зрения, этот третий, заключительный, слой фильтрационного барьера одновременно является и висцеральным (внутренним) листком капсулы Боумена-Шумлянского (парентеральный образует нефротелий, расположенный поверх её собственной базальной мембраны), и эпителием капиллярных петель клубочка.
Все подоциты имеют тело, свободно расположенное в мочевом пространстве боуменовой капсулы, и ножки (отростки) первого, второго и третьего порядков — цито-трабекулы и цитоподии (педикулы), — плотным, прерывающимся лишь в местах прикрепления мезангия слоем покрывающие капиллярные петли с наружной стороны. Подоциты очень плотно соединены с ГБМ при помощи интегринов и дистрогликановых комплексов. Между ножками подоцитов, сомкнутыми подобно молнии на одежде или пальцам двух рук, находятся щелевые диафрагмы (slit diaphragma), затянутые тонкой плёнкой, образованной преимущественно нефрином. Помимо нефрина, в состав структурных компонентов щелевой диафрагмы подоцита также входят: С02-ассоциированный белок (CD2AP), подоцин (этот белок, подобно связкам на мышцах, как бы «заякоривает» щелевые диафрагмы между ножками подоцитов), кадгерин Р, синаптоподин, FAT и денсин. Многочисленные исследования показывают, что это трансмембранный белок, относящийся к суперсемейству иммуноглобулинов с адгезивными функциями, является важнейшей частью всего почечного фильтрационного барьера, поскольку, помимо прочего, участвует в передаче межклеточных сигналов, а генетически обусловленные дефекты его синтеза и структурного расположения неизбежно приводят к тяжёлой протеинурии, гипоальбумин- и гипогаммаглобулинемии, а также к патологическому перераспределению жидкости в организме.
Совместно с ГБМ щелевые диафрагмы и плазмолемма подоцитов (Подоцитарная мембрана) несут на себе анионный заряд, благодаря чему препятствуют прохождению в первичную мочу не только крупных белков, но и мелких отрицательно заряженных, способных преодолеть размероселективность всего почечного фильтра.
|
Одним из следствий диабетической нефропатии (ДН), представляющей собой хронический гломерулонефрит, развивающийся по гиперфильтрационному типу, является деструкция белка нефрина, основного компонента щелевых диафрагм, расположенных между ножками подоцитов. Вследствие этого у больных сахарным диабетом начинает развиваться микроальбуминурия, являющаяся не только маркером, но и фактором патогенеза ДН. Установлено, что использование препаратов, контролирующих активность ренин-ангиотензин-альдостероновой системы, предупреждает диабет-обусловленную деструкцию нефрина, что было выявлено как у больных сахарным диабетом, так и на экспериментальных моделях. |
Помимо того, что подоциты образуют один из фильтрационных слоев, они выполняют и ряд других функций, например, синтезируют компоненты ГБМ и наравне с интрагломерулярными мезангиальными клетками принимают участие в фагоцитозе. Также эти эпителиальные клетки фильтрационного барьера регулируют, благодаря наличию в структуре ножек миозина II, актина и других двигательных белков из кинезинового суперсемейства сформированных в актиновые филаменты, степень растяжения капилляров клубочка (Благодаря этому подоциты, подобно мышечным волокнам, обладающим двигательной активностью, способны сокращаться и расслабляться и тем самым менять просвет капиллярной петли клубочка в зависимости от потребностей процесса мочеобразования), соотнося его с необходимым для процессов ультрафильтрации уровнем интрагломерулярного давления (т.е. наравне с афферентными и эфферентными артериолами подоциты принимают участие в поддержании эффективного фильтрационного давления в широком диапазоне системного).
Изменение структурной целостности и уникального молекулярного аппарата подоцитов часто приводит к нарушению их адгезии к ГБМ и/или диффузному сглаживанию между собой цитоподий и как следствие к реогранизации щелевых диафрагм. Подоцитурия наряду с микроальбуминурией является одним из первых признаков различных хронических заболеваний почек, а важная биологическая роль подоцитов позволила выделить даже отдельный класс нефропатии — подоцитопатии (фото 4).
Подводя итог, можно сказать, что гломерулярный фильтрационный барьер (фото 1-3) имеет сложное многоуровневое строение и в норме является механическим и электрическим барьером, не позволяющим ни крупным, ни мелким белковым молекулам проникать в первичную мочу. Поэтому даже хроническая микроальбуминурия, не говоря о прогрессирующей гиперпротеинурии, всегда является признаком нефропатии и требует как уточнения причин её возникновения, так и последующей адекватной терапии.
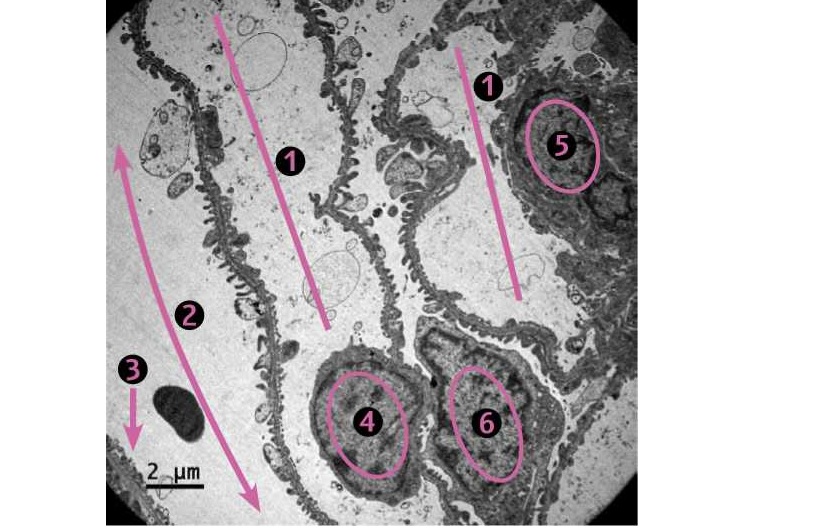
Фото 1. Кошка, ж., 11 месяцев. Клубочек почки. Область капиллярных петель.
1. Просвет капилляра. 2. Мочевое пространство. 3. Стенка капсулы Боумена (базальная мембрана + нефротелий). 4. Ядро клетки фенестрированного эндотелия (клетка фенестрированного эндотелия имеет крупное ядро и тело, растекающееся подобно плёнке по базальной мембране; эндотелиальный слой одной капиллярной петли образует всего 2-3 клетки). 5. Ядро интрагломерулярной мезангиальной клетки (основная функция — утилизация продуктов жизнедеятельности клубочка и фагоцитоз, в т.ч. ЦИК). 6. Тело и ядро подоцита (тело и ножки подоцитов содержат актиновые филаменты (или фибриллярный актин — сократительный аппарат клетки), лизосомы и микротрубочки и, кроме продукции компонентов базальной мембраны, выполняют ещё сократительную и фагоцитарную функцию). ЭМ х1260.
Гемодинамические причины развития протеинурии
Регуляция процессов мочеобразования осуществляется различными нейрогуморальными механизмами. Причём следует учитывать, что участие ЦНС в этих процессах не является превалирующим, и даже полная денервация почек не приводит к значимым нарушениям в их работе. В последнее время симпатическая денервация почек всё чаще используется для лечения стопкой артериальной гипертензии, не поддающейся контролю другими методами. Ауторегуляция мочеобразования осуществляется в основном посредством различных нейрогормонов и других биологически активных веществ (ангиотензин II, эндотелии, интраренальные простагландины), синтезируемых как в самой почке, и прежде всего её эндотелиальным дереве, так и в других частях организма (например, различные вазодилатирующие кининогены, принимающие участие в поддержании адекватного сосудистого тонуса гломерулярных артериол, образуются в печени).
Почки, кровоснабжающиеся практически напрямую из аорты и получающие до 25% крови от сердечного выброса, имеют огромное количество кровеносных сосудов различного диаметра.
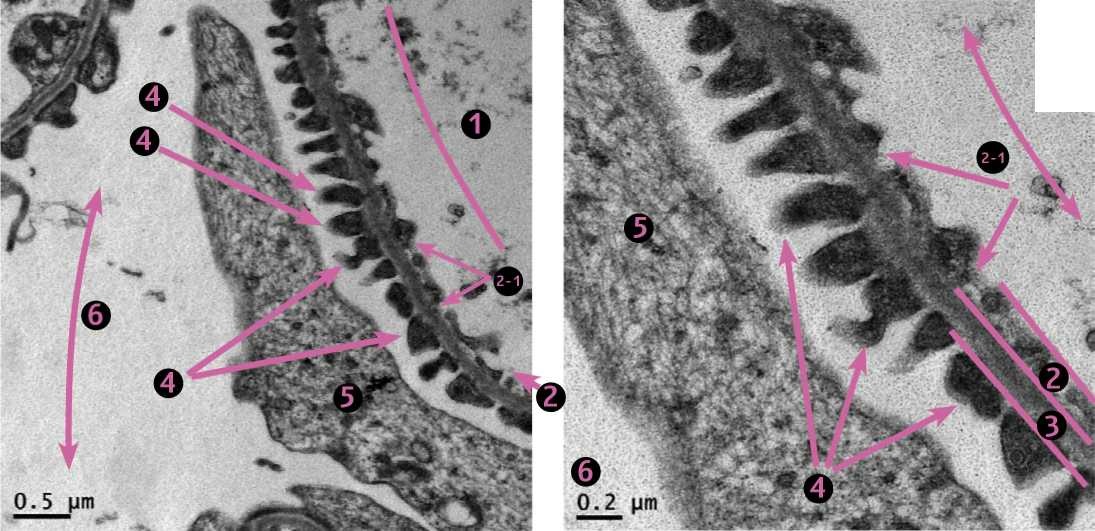
Фото 2-1 и фото 2-2. Кошка, ж., 11 месяцев. Клубочек почки. Область капиллярных петель. Гломерулярный фильтрационный барьер. 1. Просвет капилляра. 2. Фенестрированный эндотелий. 2-1. Фенестры (локальные истончения). 3. Гломерулярная базальная мембрана. 4. Цитоподии (ножки третьего порядка) подоцитов. 5. Цитотробекула подоцита. 6. Мочевое пространство. ЭМ х4000 слева и х10 000
Кроме того, первичная микрокапиллярная сеть, состоящая из приносящих и выносящих артериол и капиллярных петель клубочка, и вторичная микрокапиллярная сеть, оплетающая канальцы, принимают непосредственное участие в образовании первичной и вторичной мочи.
При гиперактивации вазопрессорных систем (в первую очередь интраренальной РААС), возникающей в результате различных патологических состояний и неразрывно связанной с нарушением целостности эндотелия первичной микрокапиллярной сети почек, развивается дисбаланс между тонусом приносящей и выносящей артериол. Эфферентные артериолы интракортикальных нефронов, и в норме имеющие значительно меньший просвет, чем афферентные, оказываются в состоянии выраженной хронической вазо-констрикции, и внутриклубочковое давление значительно повышается. По локализации клубочков в коре почек, строению канальцев и особенностям кровоснабжения различают три типа нефронов: суперфициальные, интракортикальные и юкстамедуллярные. Количество инракортикальных нефронов составляет около 80%, и именно на них лежит функция образования мочи. Афферентные и эфферентные артериолы клубочков юкстамедуллярных нефронов (18-19%) имеют одинаковый диаметр, и их микрокапилярные сети служат шунтом при избыточном кровенаполнении почки, а сами нефроны принимают значительно меньшее участие в процессах мочеобразования, чем интракортикальные.
Итогом интрагломерулярной гипертензии является перерастяжение капиллярных петель клубочка и увеличение порозности всех слоев фильтрационного барьера, приводящее в том числе и к патологической ультрафильтрации белков.
Начальный этап диабетической нефропатии характеризуется выраженной дилатацией приносящей артериолы, возникающей вследствие гипергликемии, при нормальном или чуть сниженном тонусе выносящей. Но в результате и этого дисбаланса в тонусе гломерулярных артериол уровень гиперфильтрации в капиллярных петлях нарастает, и увеличивается скорость клубочковой фильтрации (СКФ).
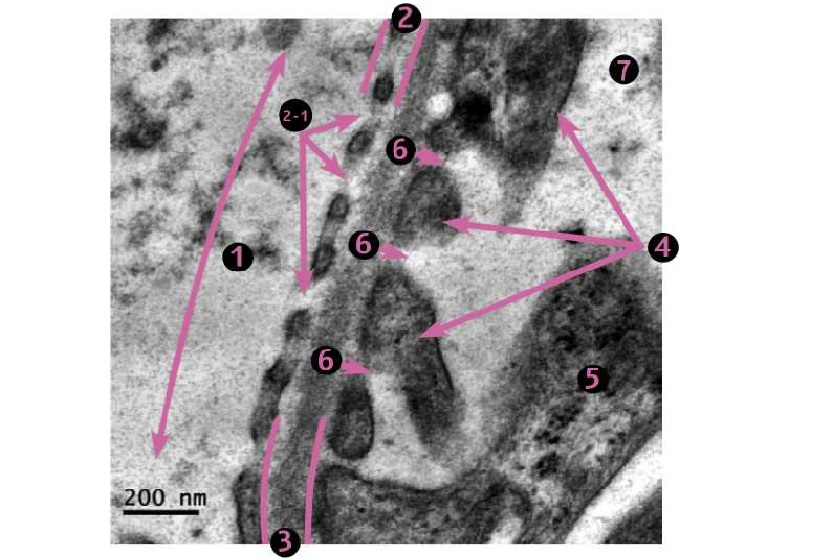
Фото 3. Кошка, ж., 11 месяцев. Клубочек почки. Область капиллярных петель. Гломерулярный фильтрационный барьер. 1. Просвет капилляра. 2. Фенестрированный эндотелий. 2-1. Фенестры (локальные истончения). 3. Гломерулярная базальная мембрана. 4. Цитоподии (ножки третьего порядка) подоцитов. 5. Цитотробекула подоцита. б. Щелевые диафрагмы, затянутые белком нефрином. 7. Мочевое пространство. ЭМ х16 000.
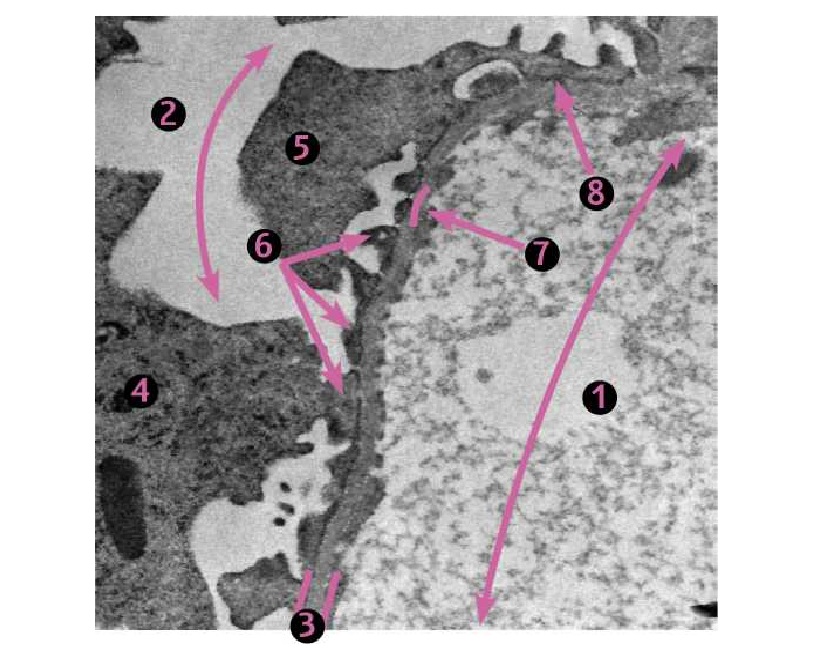
Фото 4. Кошка, ж., 2 года. Клубочек почки. Область капиллярных петель. Болезнь минимальных изменений (липоидный нефроз). 1. Просвет капилляра. 2. Мочевое пространство. 3. Базальная мембрана. 4. Тело подоцита. 5. Цитотробекулы. 6. Цитоподии. 7. Щелевые диафрагмы (норма). 8. Частичное или полное слияние ножек подоцитов с реорганизацией щелевых диафрагм различной степени выраженности (характерная гистоморфологическая особенность болезни минимальных изменений (липоидного нефроза), клиническим проявлением которого является изолированная протеинурия). ЭМ *12 000
Следствием хронической гиперфильтрации любого генеза является прежде всего нарушение целостности фенестрированного эндотелия и хроническая гиперактивация всех вазопрессорных систем. Это неизбежно приводит к прогрессирующему усугублению тяжести вазоконстрикции эфферентной артериолы и последующему уменьшению СКФ (а значит, и скорости мочеобразования) не только из-за гемодинамических нарушений, но и неразрывно связанных с ними процессов гиперклеточности и гипертрофии большинства резидентных клеток клубочка. Ключевыми непрогормонами РААС являются ангиотензин II и альдостерон. При различных нефропатиях увеличение их секреции и интенсивности рецепторных взаимодействий приводит не только к вазоконстрикции и задержке жидкости в организме, но и служит одной из ведущих причин развития гиперклеточности и гипертрофии резидентных клеток клубочка, а также инициирует и поддерживает процессы гломеруло- и нефросклероза. Итогом этих патолологических изменений является развитие не только протеинурии, но и к целого ряда других патологических процессов, итогом которых является гломеруло- и нефросклероз.
Тубулярные механизмы развития микроальбуминурии
Щёточная каёмка из микроворсинок, покрытых нитями гликокаликса, расположена на апикальной, обращенной внутрь, части клеток эпителия проксимальных канальцев. Подобно ворсинкам и криптам кишечника, щёточная каёмка многократно увеличивает площадь поверхности эпителиоцитов, необходимую для эффективной реабсорбции жизненно важных для организма веществ, попавших в первичную мочу. В случае протеинов эта функция осуществляется благодаря пиноцитозу. Процесс поглощения и внутриклеточного разрушения макромолекул. Их молекулы захватываются щёточной каёмкой эпителиоцитов проксимальных канальцев и вакуолизируются. Затем эти вакуоли начинают интенсивно передвигаться в сторону базальной мембраны канальца и в процессе этого сливаются с лизосомами. Протеолитические ферменты последних расщепляют полипептиды до аминокислот и мелких фрагментов, делая возможным их обратное всасывание в кровь, проходящую по перитубулярным (околоканальцевым) сосудам, а также реутилизацию побочных продуктов этого процесса в просвет канальца (подобным образом осуществляется процесс питания у простейших организмов).
Однако этот энергозатратный и как минимум требующий ещё и достаточного количества лизосомальных протеолитических ферментов процесс имеет определённый предел, или так называемый почечный порог выведения, достижение и прохождение которого не только приводит к появлению белков в конечной моче, но и начинает весьма отрицательно сказываться на жизнедеятельности клеток эпителия проксимального (также называемого главным) отдела канальцев. Почечным порогом выведения вещества называют ту его концентрацию в крови и/или в первичной моче, при которой оно уже не может быть полностью реабсорбировано в канальцах и появляется во вторичной моче. Причина этого в том, что реабсорбция веществ, попавших в первичную мочу, является приоритетной задачей для этого отдела канальцев и будет в случае патологии осуществляться даже в ущерб метаболическим и энергетическим интересам собственных структурных элементов. И в случае стойкой и тем более тяжёлой гиперпротеинурии, значительно превосходящей физиологическую норму, стремительно приведёт к дистрофии или даже атрофии эпителиоцитов канальцев и истончению или деструкции лежащей под ними базальной мембраны. А эти структуры не только плохо способны к регенерации, но и нарушения в их работе стремительно начинают сказываться на функционировании и остальных участков не только канальцевого, но и гломерулярного аппарата нефрона. Связано это с тем, что этот основной структурно-функциональный элемент почки имеет замкнутое строение не только с физиологической, но отчасти и с анатомической точки зрения. И нарушения в одном из любых участков нефрона обязательно приведут к структурно-функциональным изменениям во всех других.
Следует учитывать и то обстоятельство, что размер пор в гломерулярном фильтре сопоставим с размером пространства между ворсинками щёточной каёмки канальца. Поэтому реабсорбции будут подвергаться только мелкие белковые молекулы и в количестве, не превышающем канальцевый порог. Крупномолекулярные протеины хотя и не могут быть реабсорбированы и проходят через канальцевый аппарат нефрона транзитом, но успевают оказать на него выраженное токсическое влияние.
В области тёмного пятна дистальный каналец сливается или по крайней мере плотно контактирует своей стенкой со стенками афферентной и эфферентной артериол, а также с экстрагломерулярными мезангиальными клетками (также называемыми юкставаскулярными, или клетками Гурмагтига) клубочка. Благодаря этому, в частности, информация о составе вторичной мочи напрямую поступает в гломерулярный аппарат и инициирует в нём изменения, необходимые для оптимизации процессов мочеобразования в зависимости от потребностей организма в целом. Но в случае протеинурии, например, часть этих сигналов будет приводить не к оптимизации, а к извращению процессов ультрафильтрации и со временем вызовет определённые структурные изменения в фильтрационном барьере почки в частности и в гломерулярном аппарате в целом и, следовательно, приведёт к ещё большей нагрузке на канальцы из-за неизбежно возрастающего уровня белковой перегрузки. И патологический порочный круг, таким образом, замкнётся.
Неренальная протеинурия
К гиперпротеинурии (неселективной протеинурии) могут приводить не только различные нефропатии, но и целый ряд других заболеваний различных систем и органов. Пожалуй, единственной группой патологий, при которой неренальная гиперпротеинурия будет иметь формально селективный характер, могут быть названы некоторые онкологические заболевания. Селективность протеинурии в этом случае будет связана с гиперпродукцией новообразованием различных низкомолекулярных патологических полипептидов, в большом количестве свободно проникающих через гломерулярный фильтр, как, например, это бывает при миеломной болезни, когда в моче обнаруживается белок Вене Джонса (Вепсе Jones protein) с молекулярной массой около22-24 кДа. Постренальная протеинурия, как правило, не имеющая негативного влияния на деятельность почек, в некоторых случаях может быть исключена путём забора мочи на анализ чрезбрюшинным уроцистоцинтезом. Следует, правда, учитывать, что положительные (в.ч. и ложно положительные) тесты на гиперпротеинурию могут быть связаны с лейкоцит- и эри-троцитурией, являющейся обычным клиническим признаком уроциститов. При этом в моче также могут содержаться белки, являющиеся частью воспалённой слизистой мочевого пузыря. Преренальная протеинурия, развивающаяся следствием накопления в крови мелких патологических белков (например, при миеломной болезни) или интенсивным распадом тканей организма, всегда весьма отрицательно сказывается не только на процессах ультрафильтрации и мочеобразования в целом, но и сама по себе может приводить к развитию нефропатии. Для выявления причин её появления обычно требуется проведение общеклинического обследования пациента.
Преренальная протеинурия. Гемоглобинурия. Наиболее распространённой причиной её появления у собак (равно как и наиболее наглядным примером того, что клинический признак может оцениваться только как маркер заболевания, а не значимый фактор в его патогенезе, способный привести к тяжёлым последствиям) являются различные кровепаразитарные заболевания (бабезиозы) и патологии, сопровождающиеся выраженной эндотелиальной дисфункцией (лептоспироз).
Гемоглобинурия также наблюдается при переливании крови (как правило, второй и более раз; причём стремительно разрушаются не только эритроциты реципиента, но и донорские), отравлении гемолитическими ядами (в организм домашних животных они чаще всего попадают вместе с родентицидами (cовременные яды для грызунов, как правило, имеют гемолитический механизм действия)), при обширных ожогах, некоторых видах анемии, длительном переохлаждении и обильных кровоизлияниях в брюшную полость или в подкожную клетчатку. Сыворотка крови при гемоглобинурии (за исключением случаев, когда кровь попадает в мочу из мочевыводящих путей или при травмах почки и гемоглобинурия является следствием гематурии; это так называемая непрямая или ложная гемоглобинурия) окрашена обычно от слабо-розового до интенсивно-красного цвета. При гемоглобинурии в моче обнаруживается большое количество оксигемоглобина и других белков (уровень последних определяется как разница между общим уровнем гиперпротеинурии и уровнем гемоглобинурии), а также метгемоглобина, гематина и желчных пигментов. Для мочевого осадка характерно наличие глыбок аморфного гемоглобина, а также гиалиновых и зернистых цилиндров.
Вне зависимости от причин гемоглобинурии почечный фильтр сталкивается с огромным, в сотни раз превышающим физиологическую норму (pа сутки у здоровых животных в организме распадается и утилизируется не более2% эритроцитов от общего числа) количеством гемоглобина (молекулярная масса его молекулы равна 66-68 кДа). А развитие острого или хронического (в зависимости от интенсивности и/или продолжительности патологического воздействия) тубулоинтерстициального поражения при гемоглобинурии связано прежде всего с десквамацией (слущиванием) гликокаликса, а также засорением и деструкцией щёточной каёмки высокого цилиндрического эпителия проксимальных канальцев. Последующее отложение депозитов из гемосидерина и других продуктов разрушения эритроцитов в клетках эпителия проксимальных канальцев приводит к их атрофии и/или дистрофии и разрывам подлежащей базальной мембраны. Кроме того, неразрушенные эритроциты, проникающие через разрывы капиллярных петель в просвет канальцев, засоряют их с образованием цилиндрических тромбов в районе петли Генле, что со временем приводит к полному исключению идентичного нефрона из процессов мочеобразования и отёку и воспалению окружающего его интерстиция.
Миоглобинурия. При обширных ожогах, обморожениях, травмах, изнуряющих физических нагрузках, анаэробных инфекциях, отравлениях угарным газом, длительной релаксации скелетной мускулатуры во время наркоза или комы и других состояниях, сопровождающихся миозитами или массовым разрушением мышечных волокон, гиперпротеинурия обычно является следствием значительного увеличения в крови количества миоглобина. При увеличении в сыворотке этого белка свыше 25-30 мг% и более развивается миоглобинурия (также иногда называемая ложной гемоглобинурией). Миоглобин, обладающий меньшим, чем у гемоглобина, молекулярным весом (около 18-20 кДа), свободно минует гломерулярный фильтр и может быть обнаружен в моче весьма непродолжительное время после выхода из мышечной ткани (около 25-30 часов у собак и 35-45 часов у кошек). Именно поэтому угрожающие жизни нефропатии, связанные с миоглобулинурией (равно как и с гемоглобинурией, являющейся ещё одним следствием интенсивного распада мышц), могут оставаться без внимания. В кислой среде мочи часть миоглобина, не успевшего профильтроваться через стенку проксимального канальца (что само по себе имеет весьма негативное влияние на его структуры), стремительно выпадает в осадок в виде кислого гематина и, подобно эритроцитам при гематурии, закупоривает тонкий восходящий сегмент петли Генле. Кроме того, концентрируясь в дистальных отделах нефронов, этот белок оказывает прямое нефротоксичное влияние, обычно заканчивающееся острым канальцевым некрозом.
Стремительное развитие почечной недостаточности в этом случае связано не только с нарушением внутрипочечной гемодинамики, но и с несоразмерным увеличением канальцевой реабсорбции воды и NaCL из-за гиперсекреции альдостерона и вазопрессина и как следствие с истощением энергетических запасов и дистрофией эпителиоцитов и развитием олиго- или анурии и впоследствии — азотемии и гиперкалиемии. В тяжёлых случаях гистоморфологическая картина при мио- и гемоглобинурии может характеризоваться атрофией эпителия канальцев и деструкцией их базальной мембраны с локальными разрывами. Последнее неминуемо влечёт за собой гибель соответствующих нефронов в целом и развитие интерстициального воспаления.
Постренальная протеинурия. Клиническими признаками её в первую очередь может являться изменённое мочеиспускание: поллакиурия (учащённое), дизурия (болезненное и учащённое), ишурия (отсутствие мочеиспускания из-за острой задержки), странгурия (мочеиспускание маленькими порциями (по каплям).
Клинический осмотр при этом должен включать в себя пальпацию брюшной полости для оценки размеров мочевого пузыря, а также контроль состояния половых органов с целью выявления выделений, которые обычны при пиометре, баланопоститах, уретритах, вагинитах (слизисто-гнойные, иногда с примесью крови) или венерической саркоме (кровянистые). У особей мужского пола пальпаторно и при помощи УЗИ необходимо оценить размер и состояние предстательной железы, а у особей женского — рогов и тела матки. Ценные сведения о причине протеинурии также может дать УЗИ мочевого пузыря, для проведения которого необходимым условием является его наполненное состояние (в противном случае невозможно корректно оценить изменение толщины его стенок, а также визуализировать другие характерные признаки уроцистита). Если мочевой пузырь пуст, то добиться его наполнения можно либо используя петлевые диуретики (фуросемид, торасемид), либо введением стерильного физиологического раствора через уретру.
При воспалительных патологиях половых органов и нижних мочевыводящих путей моча или её осадок, кроме повышенного количества белка, будут содержать большое число лейкоцитов и/или эритроцитов, а также эпителиальных клеток. При подозрении на пиелонефрит или уроцистит необходимо проведение бактериологического исследования мочи, которую получают только путём чрезбрюшинного уроцистоцентеза.
Заболевания или состояния, которые могут сопровождаться различными типами протеинурии, приведены в таблице 2.
Заключение
Прогрессирующее увеличение тяжести ренальной протеинурии (при исключении заболеваний нижних мочевыводящих путей и половых органов) является наиболее точным маркером, свидетельствующим об усугублении течения хронических заболеваний почек (включая диабетическую нефропатию) и предвестником развития азотемии, системной гипертензии и гиперпаратиреоза. При хронической болезни почек прогрессирующая ренальная протеинурия также является крайне неблагоприятным прогностическим признаком, даже если уровень азотемии не нарастает или снижается (последнее может происходить в результате уменьшения мышечной массы пациента, развивающейся, например, из-за длительной анорексии, а не кажущегося улучшения функции почек). Протеинурия, таким образом, напрямую коррелирует с уровнем выживаемости пациентов (периодом дожития), хотя сама по себе может и не приводить к появлению каких-либо клинических признаков. Большинство угрожающих жизни нефропатии у собак и кошек годами может протекать без клинических проявлений из-за колоссальных компенсаторных возможностей почек. А появление клинических признаков, как правило, свидетельствует о том, что большая часть почечной паренхимы находится в состоянии частичной или полной деструкции.
Обнаружение протеинурии у пациента требует проведения детального общеклинического и нефрологического обследования для выявления причин её возникновения и назначения при необходимости длительной или даже пожизненной нефропротективной терапии (подавляющее большинство хронических нефропатии являются на сегодняшний день неизлечимыми патологиями). А при постоянно возрастающем уровне протеинурии, прогрессирующем, несмотря на использование различных стандартных схем лечения (для оценки эффективности нефропротективной терапии необходима по крайней мере постоянная дача одного, двух или даже трёх препаратов в течение 2-3 недель), пациенту необходимо рекомендовать проведение пункционной нефробиопсии, позволяющей не только определиться с нозологической принадлежностью нефропатии и её прогнозом, но и обозначить приоритеты в дальнейшей терапии. Рекомендовать проведение пункционноп нефробиопсии имеет смысл только тем животным, которые находятся на доклиническом этапе почечного континуума и только после проведения всех возможных неинвазивных диагностических мероприятий. На азотемическом (клиническом) этапе и при хронической болезни почек гистоморфологическая картина будет иметь хотя и ярко выраженный, но в подавляющем большинстве случаев весьма однотипный характер. Некоторым, особенно породистым, животным может потребоваться проведение исследований, необходимых для исключения генетически наследуемых нефропатии.
Таблица 2. Заболевания или состояния, сопровождающиеся различными типами протеинурии

Список литературы
1. Benigni A., Tomasoni S., Gagliardini E., Zoja С, Grunkemeyer J.A., Kalluri R., Remuzzi G., Bonnet F., Cooper M.E., Kawachi H., Allen T.J., Boner G., Cao Z. Irbesartan normalises the deficiency in glomerular nephrin expression in a model of diabetes and hypertension. Diabetologia 2001; 44:874-877.
2. Cao Z., Bonnet F., Candido R., Nesteroff S.P., Burns W.C., Kawachi H., Shimizu F., Carey R.M., De Gasparo M., Cooper ME. Angiotensin type 2 receptor antagonism confers renal protection in a rat model of progressive renal injury. J Am Soc Nephrol 2002; 13:1773-1787.
3. Damico G., Bazi С Pathophysiology of proteinuria. Kidney Int 2003; 63: 809-825.
4. De Caterina R, Caprioli R, Giannessi D, et aL n-3 fatty acids reduce proteinuria in patients with chronic glomerular disease. Kidney Int. 1993;44:843-850.
5. Frederic Jacob, David J Polzin, Carl A Osborne, James D Neaton,Claudia A Kirk, Timothy A Allen, Laurie L Swanson. Evaluation of the association between initial proteinuria and morbidity rate or death in dogs with naturally occurring chronic renal failure. Journal of the American Veterinary Medical Association 02/2005; 226(3)393-400
6. Furness P.N., Hall LL, Shaw J.A., PringleJ.H. Glomerular expression of nephrin is decreased in acquired human nephrotic syndrome. Nephrol Dial Transplant 1999; 14:1234-1237.
7. http://www.heska.com/Products/Renal-HealthScreen/ERD-HealthScreen.aspx
8. http://www.kidney.org
9. International Renal Interest Society (IRIS) [homepage on the Internet] IRIS Staging of CKD [2009] c2007. [Last accessed April 16, 2012]. Available from http://www.iris-kidney.com/guidelines/en/staging_ckd. shtmL
10. King JN, Tasker S, Gunn-Moore DA, et aL BENRIC Study Group. Prognostic factors in cats with chronic kidney disease. J Vet Intern Med. 2007;21:906-916.
11. Kuwahara Y, Ohba Y, Kitoh K, etaL Association of laboratory data and death within one month in cats with chronic renal failure. J Small Anim Pract. 2006;47:446-450.
12. Langston С Microalbuminuria in Cats. J Am Anim Hosp Assoc. 2004;40:251-254.
13. Lees GE, Brown SA, Elliot J, Grauer GF, etaL Assessment and management of proteinuria in dogs and cats: 2004 ACVIM forum consensus statement (small animal) J Vet Intern Med. 2005;19:377-385.
14. Leyenda Harley, Cathy Langston. Proteinuria in dogs and cats. Can VetJ. 2012 June; 53(6): 631-638.
15. Littman MP. Protein-losing nephropathy in small animals. Vet Clin Small Anim. 2011;41:31-62
16. Monroe WE, Davenport DJ, Saunders GK. Twenty-four hour urinary protein loss in healthy cats and the urinary protein-creatinine ratio as an estimate. Am J Vet Res. 1989 Nov;50(11):1906-9
17. Peterson JC, Adler S, Burkart JM, et aL Blood pressure control, proteinuria, and the progression of renal disease. The Modification of Diet in Renal Disease Study. Ann Intern Med. 1995;123:754-762.
18. Polzin DJ, Osbornes CA, Ross S. Chronic kidney disease. In: Ettinger SJ, Feldman EC, editors. Textbook of Veterinary Internal Medicine. 6th ed. St Louis, Missouri: Saunders (Elsevier); 2005. pp. 1756-1785.
19.VadenSL, Pressler BM, Lappin MR, etaL Effects of urinary tract inflammation and sample blood contamination on urine albumin and total protein concentrations in canine urine samples. Vet Clin PathoL 2004;33:14-19.
20. Vaden SL Glomerular disease. In: Ettinger SJ, Feldman EC, editors. Textbook of Veterinary Internal Medicine. 6th ed. St Louis, Missouri: Saunders (Elsevier); 2005. pp. 1786-1800.
21. И.И.Миронова, Л.А.Романова, В.В.Долгов. Общеклинические исследования: моча, кал, ликвор, эякулят.- М.-Тверь: 000 Издательство «Триада», 2005
22. Петросян Э. К. Подоцит: строение и роль в развитии нефротического синдрома. (Обзор литературы). Журнал «Нефрология и диализ».Т. 8, 2006 г., №2.
журнал "Современная ветеринарная медицина" №01 2014



