Володина В. В., Грушко М. П.
ФГУП «Каспийский научно-исследовательский институт рыбного хозяйства»
Введение
Каспийский тюлень (Phoca caspica) является трансграничным видом для экосистемы Каспия и встречается на всей акватории моря, от прибрежных районов Северного Каспия до берегов Ирана. В течение XX столетия численность его популяции сократилась в 2,5 раза - с 1 миллиона до 400 тыс. голов. В октябре 2008 г. каспийский тюлень был классифицирован Международным союзом охраны природы как вид «находящийся под угрозой исчезновения» из-за сокращения численности его популяции [8].
До зарегулирования промысла в 1970 г. основным фактором, определяющим численность популяции, служил нерегламентированный выбой. В последней четверти XX столетия на численность популяции стали влиять антропогенные факторы. Ухудшение условий обитания каспийских тюленей является результатом различных аспектов промышленной деятельности, в том числе разливов нефти [9]. Кроме того, были отмечены случаи массовой гибели тюленя в 1997, 1998 и 2000 гг. из-за развития инфекционных заболеваний. Инвазионные заболевания также влияют на численность поголовья P. caspica [3].
Следует отметить, что из многообразия гельминтозов лишь немногие в исключительных условиях существенным или определяющим образом влияют на динамику численности популяций животных. В развитии заболевания важную роль играет ряд биотических, абиотических и антропогенных факторов, сложившихся исключительно благоприятно в пресноводном пространстве Северного Каспия для циркуляции инвазионного начала и обеспечивающих высокую интенсивность инвазии. Так, кризис воспроизводства популяции каспийского тюленя, наблюдаемый с середины 80-х годов, является следствием неблагоприятных процессов, происходящих в экосистеме Каспийского моря. Выявлено, что на фоне подавления поллютантами иммунной системы животных прогрессируют инфекционные и паразитарные заболевания [6].
В связи с этим целью настоящей работы явилось изучение эпизоотического состояния каспийского тюленя в современных условиях на основании паразитологических показателей.
Материалы и методы исследования
С 2006 по 2010 год были проанализированы паразитологические пробы, отобранные от 45 бельков и 188 взрослых особей каспийского тюленя, добытого весной на акватории Северного Каспия в районе восточного свала Уральской Бороздины и в октябре вблизи о. Малый Жемчужный. Были обследованы следующие внутренние органы: сердце, легкие, печень, желчный пузырь, поджелудочная железа, желудок, кишечник, селезенка, почки. Паразитологические исследования полученного материала выполняли по общепринятым в паразитологии методикам [7].
Результаты и обсуждение
В ходе исследования выявлено, что внутренние органы и ткани 30-дневных щенков каспийского тюленя были свободны от паразитических форм, то есть внутриутробное заражение отсутствовало. На основании паразитологического анализа эпизоотическое состояние этой возрастной группы животных оценивается как удовлетворительное.
У половозрелых особей каспийского тюленя были выявлены следующие заболевания инвазионной природы: анизакиоз, эустронгилидоз, коринозомоз и псевдамфистомоз (табл. 1).
Каспийский тюлень является окончательным хозяином возбудителей вышеперечисленных заболеваний и заражается ими через инвазированную рыбу в процессе питания.
Возбудителем анизакиоза является нематода Anisakis schupakovi, паразитирующая в полости желудка зверя. Гельминты проникают в стенку желудка со стороны его полости. Они активно внедряются передним концом в слизистую оболочку, вызывая деструкцию тканей. Этому способствуют три кутикулярные губы на головном конце, снабженные рядом мелких зубчиков, и девять с двойными сосочками [1]. Согласно нашим исследованиям, в желудке паразитируют как половозрелые, так и неполовозрелые нематоды, интенсивность инвазии которых варьирует в пределах одногодвух порядков. Кишечник, как правило, контаминирован только личинками A. schupakovi, находящимися на IV стадии развития. Очевидно, что личинки, имея менее совершенную систему пищеварения, чем половозрелые анизакиды, в большей степени локализуются в тех отделах кишечника, где процессы переваривания пищи завершены, и происходит только всасывание питательных веществ [2]. Половозрелые гельминты в 90 % случаев локализовались в желудке, реже в тонком кишечнике и пищеводе. Гельминты, провоцировавшие развитие болезни, локализовались в желудке как одиночно, так и группами, и в последних случаях внедрение их приводило к образованию язв, легко обнаруживаемых при внешнем осмотре органа. Представители вида A. schupakovi могут проникнуть в стенку желудка глубоко, вплоть до мышечного слоя слизистой оболочки, вызывая острую воспалительную реакцию. Следует отметить, что патогенез анизакиозной инвазии определяется не только механическим воздействием личинок, проникших в слизистые, но и аллергическими реакциями организма на продукты выделения и распада паразитов.
Таблица 1. Заболеваемость каспийского тюленя, %
|
Заболевание |
Возбудитель |
2006 r. |
2007 r. |
2008 r. |
2009 r. |
2010 r. |
|
Анизакиоз |
Anisakis schupakovi |
20,0 |
10,0 |
- |
23,1 |
6,7 |
|
Эустронгилидоз |
Eustrongylides excisus |
- |
3,3 |
- |
- |
- |
|
Коринозомоз |
Corinosoma strumosum |
- |
3,3 |
- |
- |
- |
|
Псевдамфистомоз |
Pseudamphistomum truncation |
60,0 |
80,0 |
55,6 |
86,7 |
53,3 |
В отличии от анизакиса, для которого тюлень является облигатным, т. е. обязательным хозяином, Е. excisus достигают половой зрелости в желудочно-кишечном тракте рыбоядных птиц. С млекопитающими (и тюленем в частности) как с хозяином они эволюционно не связаны и по этой причине совершенно чужды его организму. Попадая в агрессивную для них среду, круглые черви активно ищут выход из нее, глубоко внедряясь в стенки желудочно-кишечного тракта и травмируя их. Эустронгилидоз у каспийского тюленя был зарегистрирован только в 2007 г. Интенсивность поражения составляла 54 экз. У 3,3 % обследованных животных в желудке обнаружены многочисленные соединительнотканные капсулы, заполненные гноесодержащим экссудатом. В 15,3 % случаев выделенные гельминты вызывали прободение стенки желудка, при этом ткани, ограничивающие сквозные язвы, были некротически изменены. У больных животных отмечена множественная перфорация стенки желудка, изъязвление, нагноение, некротические изменения прилегающих тканей, отек и гиперемия слизистой оболочки желудка, в совокупности приведшие к нарушению функционирования этого органа.
В 2007 г. у P. caspica было зарегистрировано еще одно заболевание инвазионной природы - коринозомоз, возбудителем которого являлись скребни С. stramosum (рис. 1).
Для определения локализации С. stramosum нами подсчитывалось число паразитов этого вида на участках кишечника: 0-3, 3-6, 6-9, 9-12, 12-15 м. Результаты исследований показали, что паразиты на отдельных участках кишечника распределялись нерав-
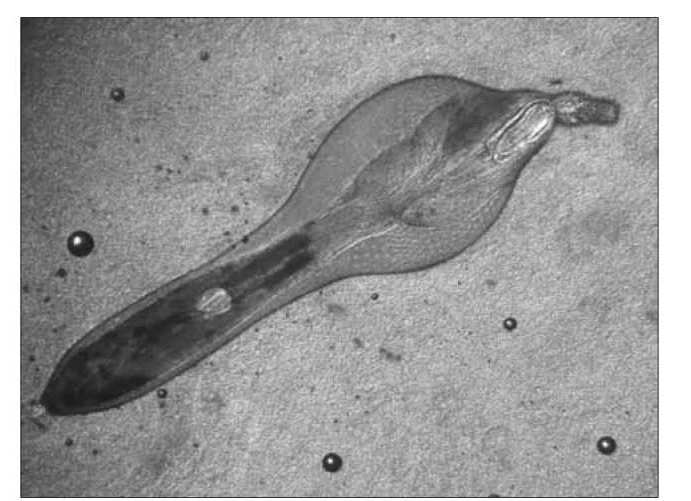
Рис. 1. Возбудитель коринозомоза - С. strumosum.
номерно:0-3м-0,91%;3-6м-4,97%;6-9м-41,11 %; 9-12 м - 52,26 %; 12-15 м - 0,75 %. Таким образом, выявлено, что большая часть скребней была сосредоточена в последней трети тонкой кишки. Интенсивность инвазии этого участка кишечника достигала 3 366 экз. Патологические изменения, вызываемые единичными скребнями, были незначительными, затрагивали в основном слизистую оболочку органа. В местах внедрения паразита в стенку кишечника развивались отек и мелкоочаговая гиперемия, а в зоне непосредственной локализации паразитов наблюдали деструкцию слизистой оболочки в результате механического повреждения хоботками С. stramosum. Однако при интенсивности инвазии более 3 000 экз. в зоне локализации гельминтов воспалялась вся слизистая оболочка, образуя макроочаг, что могло стать причиной нарушения функционирования этого органа.
Возбудителем псевдамфистомоза у каспийского тюленя являются мариты трематоды Ps. trancatum (рис. 2). Согласно классификации Крылова В. И. (1982) были выделены четыре стадии развития псевдамфистомоза [4]. Данное инвазионное заболеванне выявляли во все годы исследования (табл. 1,2).
Таблица 2. Уровень заболеваемости каспийского тюленя псевдамфистомозом в 2006-2010 гг., %
|
Стадия псевдамфистомоза |
2006 г. |
2007 г. |
2008 г. |
2009 г. |
2010 г. |
|
Нулевая |
30,0 |
11,1 |
37,5 |
26,7 |
6,7 |
|
Первая |
20,0 |
38,9 |
18,8 |
26,7 |
33,3 |
|
Вторая |
0,0 |
22,2 |
6,2 |
20,0 |
6,7 |
|
Третья |
10,0 |
5,6 |
6,2 |
13,3 |
6,7 |
Нулевая стадия заболевания характеризовалась бессимптомным паразитоносительством, т. е. видимые патологические изменения со стороны серозных покровов органов не обнаружены. Мариты трематод находились в свободном состоянии в содержимом желчного пузыря, печени и желчных протоках.
При первой стадии заболевания у пораженных особей наблюдали утолщение стенок желчного пузыря и желчных протоков за счет разрастания соединительной ткани. Размеры наростов, обнаруженных на поверхности желудочно-кишечного тракта, печени, селезенки, варьировали от 0,5 до 2,5 см в диаметре. На поверхности печени находились гнойные капсулы, содержащие трематод.
У больных зверей, находящихся на второй стадии развития псевдамфистомоза, наблюдали перерождение желчных протоков и паренхиматозной ткани, сопровождающееся образованием крупных опухолей диаметром до 12,0 см, заполненных трематодами и гнойными массами. Стенки желчного пузыря были толстыми, на разрезе ячеистыми, при надавливании выделялась густая слизь с большим количеством трематод.
Третья стадия развития псевдамфистомоза характеризовалась высокими показателями интенсивности инвазии (от 4 000 до 63 000 экз.). Патоморфологическое обследование больных тюленей выявило множественные, обширные бугристые уплотнения в печени, ее гипертрофию и мозаичность окраски. Обнаружены новообразования в печени, поджелудочной железе и тонком кишечнике, анатомическое строение печени и поджелудочной железы при этом было ча-
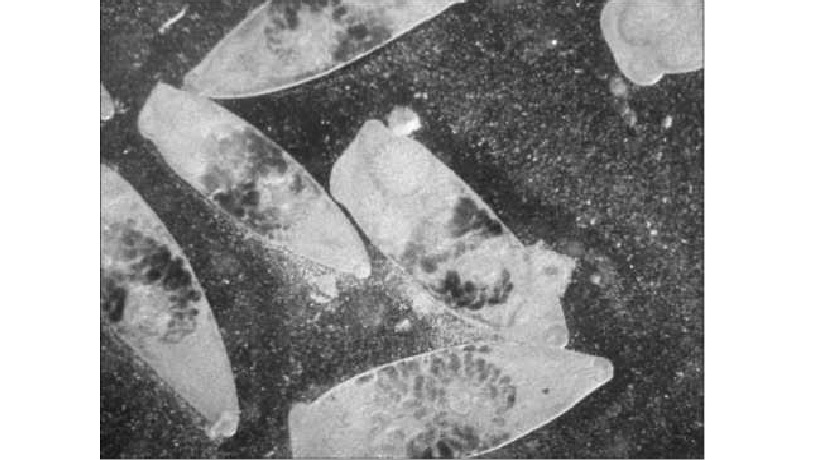
Рис. 2. Возбудитель псевдамфистомоза — трематода P. truncatum.
стично или полностью нарушено. На разрезе пораженные участки были гладкими и очень твердыми. При соскобе выделялась незначительная часть секреторной массы, содержащей трематод.
Расчетные данные многолетних исследований свидетельствуют, что для каждой стадии псевдамфистомоза существует пороговая интенсивность инвазии (табл. 3).
Статистический анализ показал, что интенсивность заражения тесно коррелирует (г| = 0,91) с толщиной подкожного сала, то есть тяжесть заболевания проявляется в изменении упитанности больных зверей. Так, жировая прослойка здоровых животных за весь период исследования (2006-2010 гг.) составляла 5,7±0,29 см, на нулевой стадии псевдамфистомоза меньше на 8,8 % (5,2±0,41 см), на первой - на 26,3 % (4,2±0,39 см), на второй -на 36,8 % (3,6±0,45 см), на третьей -на 38,6 % (3,5±0,54 см). Также выявлена линейная зависимость толщины подкожной жировой клетчатки от стадии развития заболевания (рис. 3).
Таблица 3. Средние значения интенсивности инвазии и массы каспийского тюленя при разных стадиях псевдамфистомоза
|
Стадия заболевания |
Средняя интенсивность инвазии, экз. |
Средняя масса, кг |
|
Нулевая |
15б,2±36,28 |
43,2±5,01 |
|
Первая |
1 005,1±126,31 |
35,6±4,20 |
|
Вторая |
5 856,1±1 123,80 |
27,8±6,71 |
|
Третья |
23 253,2±22 321,50 |
28,0±4,12 |
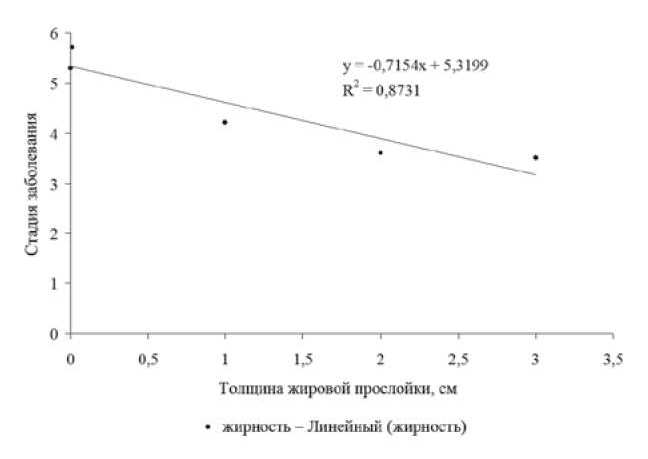
Рис. 3. Зависимость толщины подкожной жировой прослойки от стадии развития псевдамфистомоза.
В целом, паразитирование приводит к ослаблению барьерных функций организма, и служит причиной возникновения вторичных инфекций. Очевидно, что часть высоко инвазированных и недостаточно упитанных зверей в период зимней бескормицы погибнет («естественная» смертность).
Заключение
Таким образом, больные вышеописанными заболеваниями животные относятся к «группе риска», то есть вследствие изменения степени влияния биотических и абиотических факторов их заболевание может завершиться летальным исходом.
В целом в результате исследований (2006-2010 гг.) у взрослых особей каспийского тюленя выявлено четыре инвазионных заболевания (псевдамфистомоз, анизакидоз, эустронгилидоз, коринозомоз). Выявленные патологические изменения в органах и тканях, вызванные паразитированием патогенных гельминтов, свидетельствуют о неблагополучном состоянии обследованных зверей.
Список литературы
1. Делямуре, С. А. О гельминтофауне каспийского тюленя (Phoca caspica Gmelin, 1788) / С. А. Делямуре, Ю. В. Курочкин, А. С. Скрябин // Тр. Астр, заповедника. - В. 9, 1964. - С. 105.
2. Демиденко, Л. А. Особенности локализации гельминтов в органах пищеварительной системы каспийского тюленя (Phoca caspica Gmelin, 1788) / Л. А. Демиденко, В. А. Королев // Морские млекопитающие Голарктики. Сборник научных трудов. По мат. Третьей междунар. конференции. Коктебль, Украина 11-17 октября 2004 г. - М., 2004. - С.180-183.
3. Заблоцкий, В. И. К вопросу о воздействии на состояние и численность популяции каспийского тюленя заболевания псевдамфистомозом / В. И. Заблоцкий, Л. С. Хураськин, Г. А. Ворожцов // Отчетная сессия КаспНИРХа по работам 1973 г. Тезисы докладов (май 1975 г.). - Астрахань : Изд-во КаспНИРХа, 1975. - С. 95-96.
4. Крылов, В. И. Инвазия каспийского тюленя трематодой Pseudamphistomum truncatum в авандельте Урала/ В. И. Крылов // Морские млекопитающие. - Л. : Наука, 1982.-С. 13-136.
5. Крылов, В. И. Эколого-статистический анализ заболевания каспийского тюленя авандельты Урала псевдамфистомозом / В. И. Крылов, В. Н. Попов // Некоторые аспекты биологии и экологии каспийского тюленя. -М. : ВНИРО, 1990. - С. 17-34.
6. Крючков, В. Н. Патологические изменения внутренних органов тюленя на фоне накопления хлорорганических соединений / В. Н. Крючков, Н. Н. Федорова, Г. В. Земков, Л. А. Антонова // Вестник Астраханского Технического Университета. — 1994. -№1. -С. 99-102.
7. Скрябин, К. И. Метод полных гельминтологических вскрытий позвоночных, включая человека / К. И. Скрябин. - М., 1928. - 186 с.
8. Харконен, Т. Значительные межгодовые колебания рождаемости у каспийского тюленя, Phoca caspica, в период 2005-2010 гг. и последствия для сокращающейся популяции / Т. Харконен, М. Т. Баймуканов, А. Бигнерт и др. // Морские млекопитающие Голарктики. - 2010. - С. 596-598.
9. Харконен, Т. Количество появившихся детенышей и районы размножения каспийского тюленя Pchoca caspica под влиянием антропогенных факторов / Т. Харконен, М. Джусси, М. Балмуканов, А. Бигнерт, Л. Дмитриева, Е. Касимбеков, М. Веревкин, С. Вильсон, С. Дж.Гудман // Амбио. - Июль 2008. - Т. 37. - №5.-С. 356-361.
Актуальные вопросы ветеринарной биологии № 2 (14), 2012



