В. МИТИН, Е. САУТИН, Ю. СОЛОВЬЕВ
Лечение опухолей костей у собак по-прежнему остается актуальной и одной из наиболее сложных областей ветеринарной медицины. В этом вопросе существенно выделить три проблемы: раннюю диагностику опухоли, профилактику легочных метастазов и необходимость сохранения больной конечности. Последней проблеме посвящена настоящая статья.
Возможность значиельного продления жизни больным животным современными средствами заставила врачей задуматься о «качестве» их жизни. Из существующих операций наиболее популярными стала не ампутация и экзартикуляция конечности, практикуемые ранее, а широкая сегментарная резекция кости с заполнением дефекта трансплантатом или другим имплантационным материалом, позволяющая сохранить ногу. При этом выбор материала для замещения дефекта открыл хирургам на многие годы широкое поле для научной деятельности. В настоящее время предпочтением пользуются ауто- и гомотрансплантаты кости и керамические эндопротезы, имеющие конкретные показания и противопоказания к применению. Но все же идеальной для пластики остается аутокость.
Почти 70 лет назад Р.П. Вреден предложил для заполнения больших дефектов длинных трубчатых костей после резекции костных опухолей реплантацию вываренных резецированных фрагментов. С помощью реплантатов удавалось идеально заместить дефект, однако вследствие термической обработки они оказывались биологически инертными и не подвергались процессам перестройки в организме, из-за чего обладали недостаточной механической прочностью.
Позднее, в 1983 г., Е.Н. Саутиным была рекомендована модификация условий обработки реплантатов, заключающаяся в замораживании резецированной кости от -40 до -70 °С и облучении (1,5—3,5 мрад) в расчете на полное уничтожение опухоли в кости с сохранением ее биологической активности.
В 1988 и 1989 гг. независимо друг от друга Uyttendeele и Inoue сообщили об аналогичных клинических наблюдениях, которые показали, что одномоментное экстракорпоральное облучение рентгеновскими лучами или электронным пучком в дозе 50-300 Гр достаточно инактивирует злокачественную опухоль кости.
С 1981 по 1994 г. в Клинике экспериментальной терапии ОНЦ РАМН при разработке комплекса лечебных мер в отношении остеогенной саркомы как отдельный фрагмент работы проводились исследования по «реплантации» на собаках со спонтанными опухолями. Этическая сторона эксперимента была обоснована тем, что, во-первых, в зависимости от вида опухоли животные получали системную адьювантную противоопухолевую терапию, во-вторых, четко определялись показания к радикальной операции.
Очевидными преимуществами данного типа реконструкции являются:
а) отсутствие иммунологической реакции и риска вирусного поражения аллогенного трансплантата;
б) отсутствие таких осложнений, связанных с протезированием, как разбалтывание сустава, разрыв и износ;
в) использование естественных механических функций пораженных участков кости, поскольку внеклеточная архитектоника кости не страдает при данных дозах облучения.
Следует напомнить, что костные саркомы у собак протекают аналогично этому заболеванию у человека с неизбежным, преимущественным метастазированием в легкие, но в гораздо более короткие (в 4 раза быстрее) сроки.
Работа по реплантации облученных костных фрагментов была выполнена на 15 собаках крупных пород в возрасте от 2 до 9 лет, со спонтанным опухолевым поражением длинных трубчатых костей, из числа которых остеогенная саркома (рис. 1) морфологически была установлена в десяти случаях, паростальная — в двух, хондро-саркома — в одном, злокачественная фиброзная гистиоцитома — в одном, синовиальная саркома с вторичной остеодеструкцией — в одном случае.
Все животные были обследованы и оперированы во II стадии процесса. Операции выполнялись под общим многокомпонентным наркозом в соответствии с общепринятыми методами абластики и антибластики, одномоментно включая этап обработки реплантата.
Формирование групп проводилось в зави-симости от вариаций воздействия на реплантат. Животные наблюдались в клинике до естественной смерти, затем производилось вскрытие, с макро- и микроскопической оценкой состояния реплантата.
Перед началом исследований, исходя из цели получения идеального пластического материала, были определены следующие основные задачи.
Разработать способ обработки реплантата, обеспечивающий полное уничтожение опухолевых клеток при сохранении способности кости к перестройке.
Разработать показания к применению реплантации.
Подобрать оптимальный способ фиксации реплантата в тканях и характер реабилитационных мероприятий по восстановлению функций оперированной конечности.
В связи с этим было раздельно проведено изучение влияния облучения, замораживания или только хирургического вмешательства на состояние опухоли в резецированном фрагменте кости.
Вначале было установлено, что облучение пораженного фрагмента вне организма в дозе 300 Гр вызывает гибель опухолевых клеток без сохранения потенции к возобновлению роста, но при этом утрачивается способность нормальных костных структур реплантата к перестройке в тканях, что напоминает поведение «вываренной» кости. Реплантат остается изолированным от окружающих тканей даже через 20 недель (рис. 2).
Затем было изучено влияние на состояние опухоли в реплантате собственно резекции без дополнительной обработки кости и сочетанного влияния резекции с замораживанием. Анализ полученных результатов в этой группе свидетельствовал о том, что данные факторы вопреки облучению не вели к гибели опухолевой ткани, в связи с чем с началом нормальной перестройки кости и врастанием тканей, а также сосудов в реплантат (рис. 3) возникал рецидив опухоли через 17—37 недель после операции.
В дальнейших исследованиях изучалось сочетанное влияние резекции, замораживания
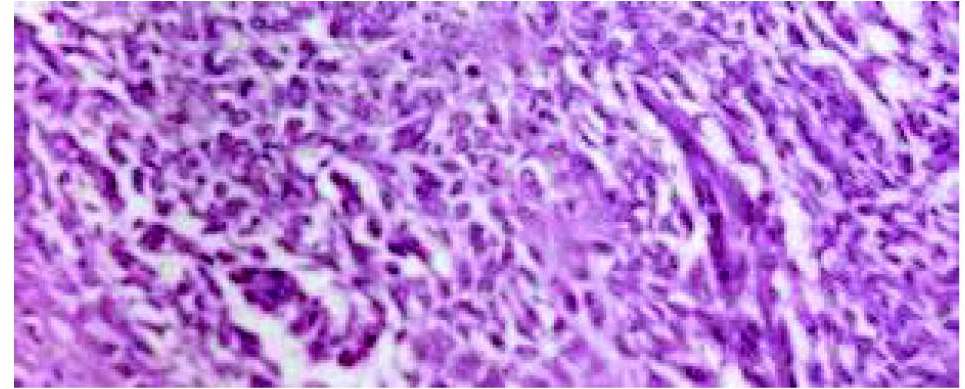
Рис. 1.
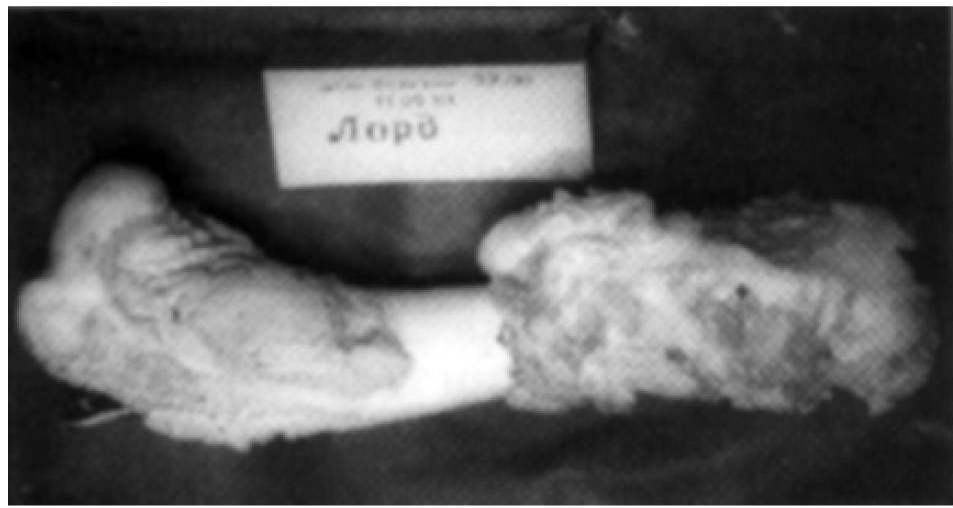
Рис. 2.
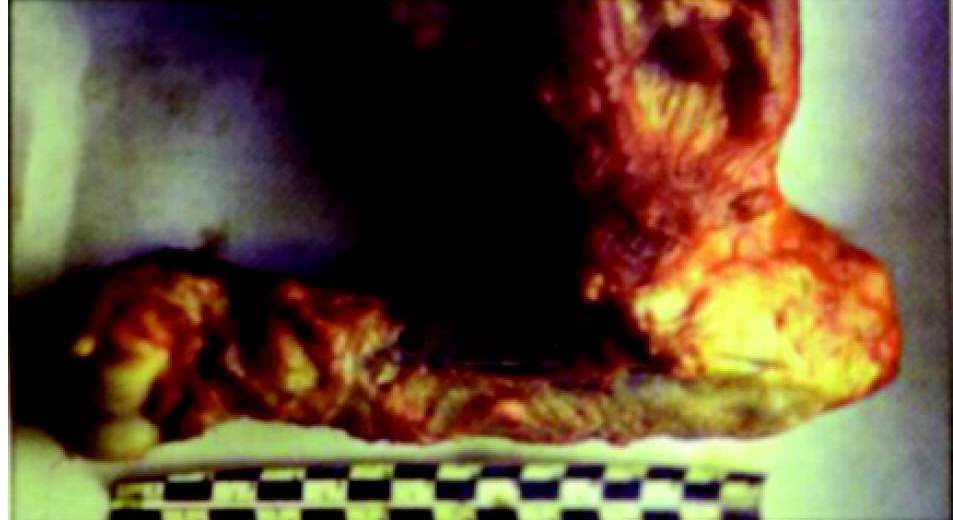
Рис. 3.
и облучения на состояние опухолевой ткани в реплантате и инкорпорацию нормальной кости. Резецированный фрагмент скелетировали от мягких тканей, замораживали при температуре от 0 до -8° С, подвергали облучению (100—300 Гр). Скелетирование являлось необходимым, так как при регенерации операционной раны мягкие ткани реплантата «выболевали». В процессе исследований была обнаружена возможность уменьшить дозу облучения до минимально допустимой границы — 100 Гр, проводя сеанс облучения на гамма-аппарате «Стебель» с источником Csl37 всего за 13 минут. Минимально необходимая однократная доза облучения, гарантирующая полное уничтожение опухолевых клеток в реплантате, была подобрана эмпирически с учетом данных. Кроме того, реплантат замораживали не в жидком азоте, как это делали вначале, что в одном случае вызвало гидродинамический разрыв кости, а охлаждали его сухим льдом. В целом это облегчало и оптимизировало условия обработки реплантата.

Рис. 4.
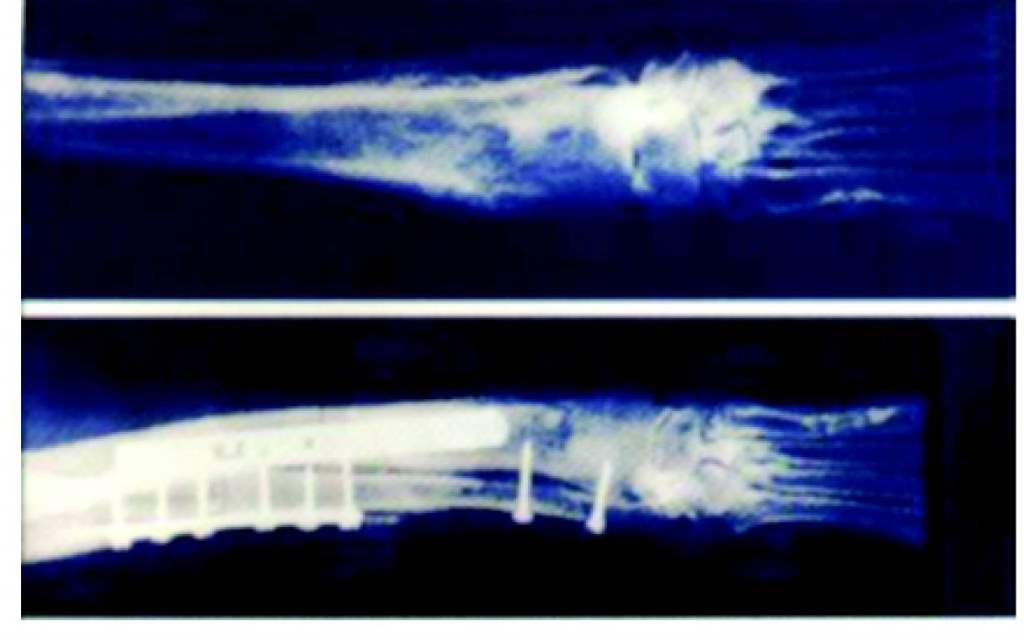
Рис. 5, 6.
По результатам наблюдений, сделанных за период от 7 до 20 недель, сочетанное воздействие приводило к гибели опухолевой ткани в реплантате, исключающей возможность ее дальнейшего развития. На секции животных мы отмечали врастание в кость окружающих тканей, восстановление структур сустава и т.п., тоесть изменения, характеризующие закономерные этапы перестройки кости.
Клинически у животных с первых дней после операции восстанавливалась способность опираться на больную конечность (рис. 4), заживление операционной раны происходило в большинстве случаев первичным натяжением, через месяц восстанавливалась функция сустава. На рентгенограммах отмечалось формирование костной мозоли между материнской костью и реплантатом (рис. 5, 6). Осложнения были представлены в основном нагноением ложа реплантата (15%).
Пример. Собака Д., немецкая овчарка, самка, 7 лет, поступила в клинику с диагнозом «остеогенная саркома дистального отдела левой лучевой кости, остеопластический вариант, II стадия». В соответствии с избранным планом лечения предоперационно ей была проведена региональная химиотерапия адриа-мицином в СД* = 30 мг/кв.м и выполнено облучение опухоли в СОД** = 30 Гр. (* Суммарная доза. ** Суммарная очаговая доза.)
Животное было оперировано в объеме широкой сегментарной резекции пораженного отдела кости, с последующим одномоментным экстракорпоральным облучением фрагмента в охлажденном состоянии и реплантацией фрагмента в ткани.
Состояние через 1 месяц: тивация опухолевой ткани происходит только под воздействием ионизирующей радиации. Полагаем, что в будущем выполнение реплантации возможно в тех случаях костных сарком, когда остаются неразрушенными суставная поверхность и большая часть кортекса. В связи с этим использование реплантации может быть показано в первую очередь при остеопластических остеогенных и паростальных саркомах. Оптимальными условиями обработки резецированного костного фопороспособность в лонгете с первого дня, заживление операционной раны произошло первичным натяжением. Со слов владельца, собака легко передвигается, преодолевает барьеры.
В сравнении с консервированными гомот-рансплантатами реплантаты, по нашему мнению, легче переносили внедрение металлоконструкций, выдерживали статические и механические нагрузки, возникающие при движении животного. Ограниченные кортикальные дефекты существенно не сказывались на прочности реплантатов, однако, в последнее время авторам удалось сохранять минерализованные опухолевые структуры для увеличения прочности кости.
Таким образом, на основании сделанных наблюдений можно заключить, что в резецированном фрагменте кости инакрагмента для его последующей реимплантации считаем скелетирование кости, охлаждение ее сухим льдом и облучение в дозе 100 Гр. Однако сегодня нерешенным остается вопрос выбора лучшего способа фиксации реплантата в тканях.



