ПОРАЖЕНИЯ ГЕПАТОБИЛИАРНОГО ТРАКТА ПРИ ЦИРКОВИРУСНОЙ ИНФЕКЦИИ У СВИНЕЙ
AM. БУТЕНКОВ
ГНУ «Северо-Кавказский зональный научно-исследовательский ветеринарный институт», г. Новочеркасск
Цирковирусная инфекция свиней - это чрезвычайно широко распространенное заболевание. В хозяйствах заболевание чаще всего проявляется синдромом мультисистемного истощения, патологией беременности. Это объясняет морфологическую и функциональную недоразвитость органов пищеварения, нервной, сердечнососудистой, ретикулоэндотелиальной и других систем.
У поросят отмечается патология обмена веществ, в первую очередь сказывающаяся на интенсивности биосинтеза белков, в том числе ферментов, гормонов, иммуноглобулинов, в крови задерживается фетальный гемоглобин, возникают явления гипоксии. Эти процессы приводят к развитию субклеточных изменений, определяющих характер метаболических процессов, а нарушение последних проявляется патологией печени.
Цирковирус - ДНК-содержащий вирус, вызывающий заболевание у нескольких видов животных. Существует два типа вируса - PCV-1 и PCV-2. Цирковирус типа 2 вызывает у свиней синдром послеотъемного мультисистемного истощения (СПМИ). Однако болезнь проявляется в том случае, когда цирковирус действует синергично с другими возбудителями. Например, парвовирус, вызвавший ослабление иммунной системы, может спровоцировать возникновение цирковирусной инфекции у поросят-вирусоносителей.
Синдром впервые был описан в 1991 году в восточной Канаде (G.M. Allan, J.A. Ellis, 2000). Уже в 2000 году его регистрировали на всей территории Канады, США и в некоторых странах Европы.
Синдром мультисистемного истощения наиболее часто наблюдается у поросят в возрасте 5-18 недель. Заболевшие поросята теряют в весе, становятся слабыми и худыми.
Клинически болезнь может проявляться поражением многих паренхиматозных органов, в том числе и печени (S. Krakowka, J. Ellis, F. McNeilly et al., 2004).
Несмотря на многочисленные публикации об этом заболевании в зарубежной литературе, многие вопросы патогенеза, клиники и лечения синдрома послеотъемного мультисистемного истощения (СПМИ) требуют дальнейшей теоретической проработки и переведения исследований в чисто практическую плоскость - совершенствование методов диагностики и разработки эффективных методов профилактики. Развитие синдрома послеотъемного мультисистемного истощения тесно связано с хронизацией процессов повреждения иммунной системы и печени. В то же время в доступной литературе отсутствует достаточное количество информации об особенностях поражения печени у свиней, больных разными формами синдрома послеотъемного мультисистемного истощения. Остаются малоизученными морфофункциональные изменения печени при данном заболевании.
Цель и задачи исследования. Исходя из вышеизложенного, целью нашей работы явилось уточнение клинических, лабораторных и морфологических особенностей поражения печени у свиней при синдроме послеотъемного мультисистемного истощения на разных стадиях его развития.
Материалы и методы исследования. Для решения поставленных задач нами были обследованы 284 свиньи с диагнозом синдрома послеотъемного мультисистемного истощения, который был поставлен методом выделения ДНК PCV-2 в ПЦР. Все животные были подвергнуты эвтаназии или посмертному патологоанатомическому вскрытию с последующим морфологическим исследованием печени.
Из образцов печени, фиксированных в формалине и заключенных в парафин, изготовляли серийные срезы толщиной 4 мкм с последующей окраской гематоксилином и эозином. С помощью ШИК-реакции (реакция шифф-йодной кислотой; Г.А. Меркулова, 1969) выявляли гликоген и гликопротеины. Углеводы, содержащие гексозу, окрашиваются в красно-лиловый цвет (эндотелий сосудов), а гликоген - в более интенсивный темно-красный.
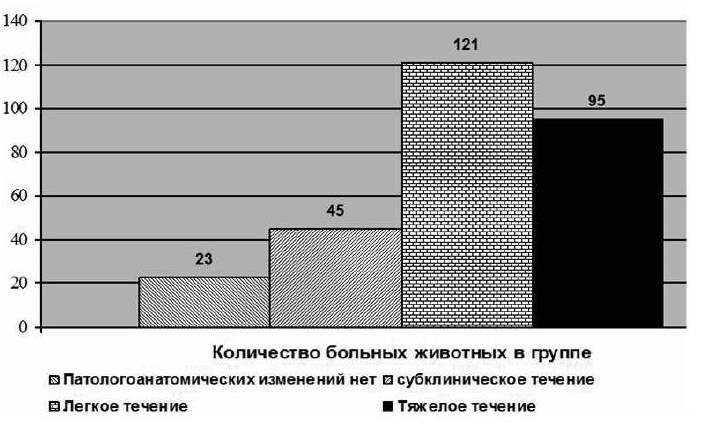
Рис. 1. Распределение больных животных по группам
Всех животных можно разделить на 4 группы: животные-носители, животные с субклиническим течением, с легким течением и тяжелым течением заболевания (рис. 1).
У животных первой группы, несмотря на выделение ДНК PCV-2 методом ПЦР, патологоанатомических изменений не обнаруживалось, и синдром мультисистемного истощения не наблюдался.
У животных второй группы заболевание протекало субклинически. Субклиническое течение болезни было определено у больных поросят после эвтаназии. При этом симптомы болезни отсутствовали, но в печени имелись минимальные гистологические изменения. Они характеризовались одно- или многоцентральным распределением лимфоцитов и плазматической рассеянной инфильтрацией в портальной триаде и печеночных дольках (рис. 4). Гепатоциты были гистологически нормальными.
Легкое течение заболевания характеризовалось лишь более низкими живой массой и привесами. У некоторых животных отмечались периодические диареи, хотя свиньи охотно принимали корм и оставались достаточно подвижными. Патологоанатомические изменения определяли после эвтаназии. У этих животных отмечалось увеличение размера печени, закругление ее края, увеличение желчного пузыря, мускатный рисунок печени (рис. 2, 3). Гистологические изменения в печени характеризовались лимфоцитарными инфильтратами портальных триад и печеночных долек (рис. 4). Отмечались фокальные некрозы, локальные расширения синусов с инфильтрацией лимфоцитами и мононуклеарными клетками (рис. 5, 8). Гепатоциты были гистологически нормальными.
В группе животных с тяжелым течением заболевания исследовались поросята, умершие перед запланированной датой эвтаназии или находившиеся в предсмертном состоянии, с выраженным синдромом послеотъемного мультисистемного истощения. В легких, осложненных вторичной бронхопневмонией, иногда отмечали слабую интерстициальную пневмонию и септальное грануломатозное воспаление (Clark E.G., 1997). У двух свиней серозная поверхность печени, кишечника и почек содержала остатки фибринозно-гнойного воспаления, это сочеталось с бактериальной септицемией или перитонитом. У этих 2 животных обнаружили незначительные автолитические изменения, говорящие о том, что поросята умерли за несколько часов до вскрытия и отбора материала.
Патоморфологические изменения в печени у свиней с тяжелым течением послеотъемного мультисистемного истощения чаще всего соответствовали портальному и лобулярному морфологическим вариантам поражения органа. При портальном варианте обнаруживали отёк и расширение портальных трактов с инфильтрацией их лимфогистиоцитарными элементами. Гепатоциты находились в состоянии гидропической и жировой дистрофии (рис. 9, 10, 11). При лобулярном варианте гепатита чаще обнаруживались некрозы печёночных клеток (рис. 6), иногда они носили сливной характер, располагались преимущественно в центральных отделах печёночных долек. Реже синдром послеотъемного мультисистемного истощения протекал по перипортальному варианту. Для него характерно было наличие инфильтрации портальных трактов макрофагами, лимфоцитами; инфильтрат мог проникать внутрь дольки, разрушая пограничную пластинку (рис. 12, 13). Отмечалась лимфоцитарная и моноцитарная инфильтрация портальных трактов от умеренной до выраженной, единичные ступенчатые некрозы гепатоцитов, гепатоциты в состоянии гидропической дистрофии слабой и умеренной степени (рис. 10, 11).
В портальных трактах отмечалась пролиферация эпителия в междольковых желчных протоках. Однослойное строение тяжей (балок) гепатоцитов местами было нарушена, отмечалась выраженная их извитость, и узлы регенерации, гепатоциты выстраивались в виде розеток, но уже в этих розетках регенерации отмечался каликвационный некроз (рис. 6). Слой гепатоцитов, непосредственно прилегающий к портальному тракту, так называемая замыкающая пластинка даже при тяжелом течении заболевания оставалась гистологически интактна. В синусоидах отмечалась дегенерация эндотелиальных клеток, местами их десквамация и гибель гепатоцитов и пролиферация клеток Купфера. В гепатоцитах центральных отделов долек отмечалась гидропическая или баллонная дистрофия. Вместе с тем рассеянно по всем дольками печени встречались гепатоциты в состоянии геалиновокапельной дегенерации, которая местами доходила до формирования телец Каунсильмена (рис. 5, 7), крайней степени геалиново-капельной дегенерации с некрозом гепатоцита. Для тяжелого течения цирковироза особенно характерно проникновение инфильтрата из лимфоцитов, макрофагов, плазматических клеток через пограничную пластинку в печеночную дольку, что не отмечалось при более легком течении заболевания. Некрозы носили ступенчатый характер, но локально отмечались мостовидные и субмассивные поражения. Деструкция гепатоцитов сочеталась с очаговой или диффузной пролиферацией звездчатых ретикулоэндотелиоцитов и клеток холангиол (рис. 6, 8).
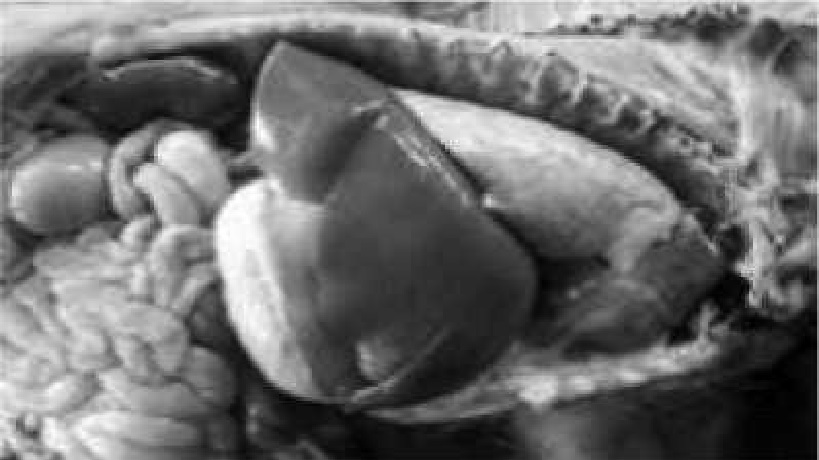
Рис. 2. Вид печени при синдроме мультисистемного истощения

Рис. 3. Закругленный край печени, увеличенный желчный пузырь, мускатный рисунок печени
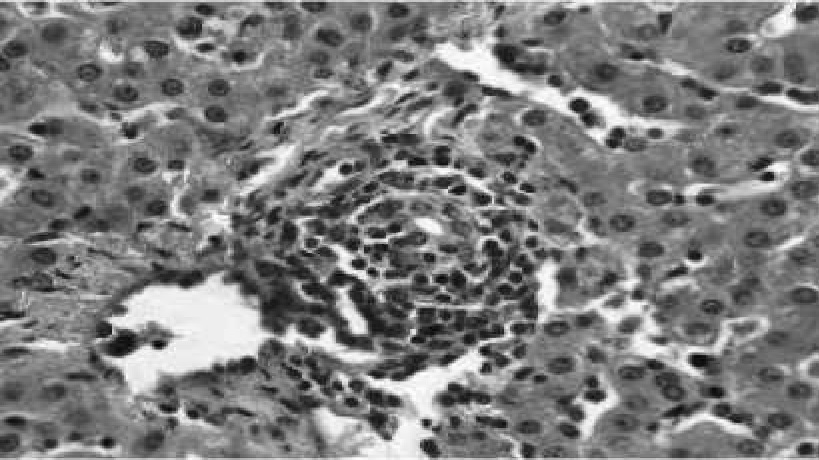
Рис. 4. Перипортальный мононуклеарный инфильтрат. Гематоксилин с эозином, 10x40
Заключение. Таким образом, при клинически выраженном течении синдрома послеотъемного мультисистемного истощения свиней развиваются дистрофические и некробиотические изменения гепатоцитов с формированием ступенчатых некрозов, пролиферацией гепатоцитов с формированием розеток и последующим их некрозом. На фоне гидропической и жировой дистрофии отмечается дессиминированная геалиновокапельная дегенерация гепатоцитов с формированием телец Каунсильмана.
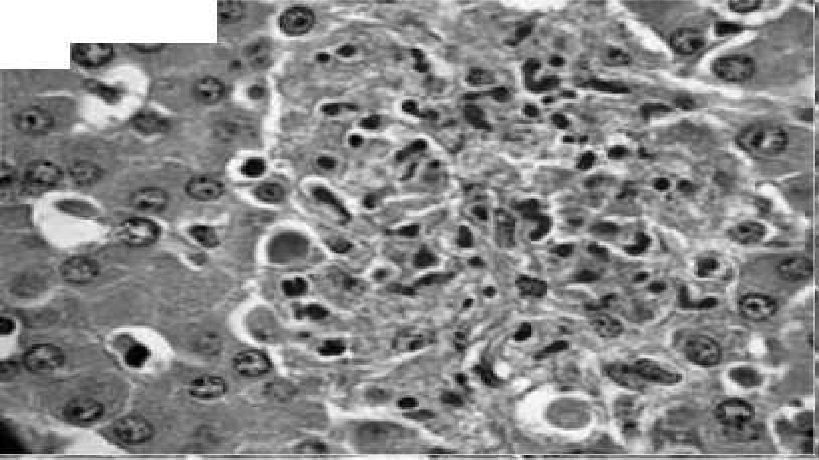
Рис. 5. Ацидофильные тельца (Каунсильмена). Гематоксилин с эозином, 10x40

Рис. 9. Жировая дегенерация гепатоцитов. Гематоксилин с эозином, 40x10
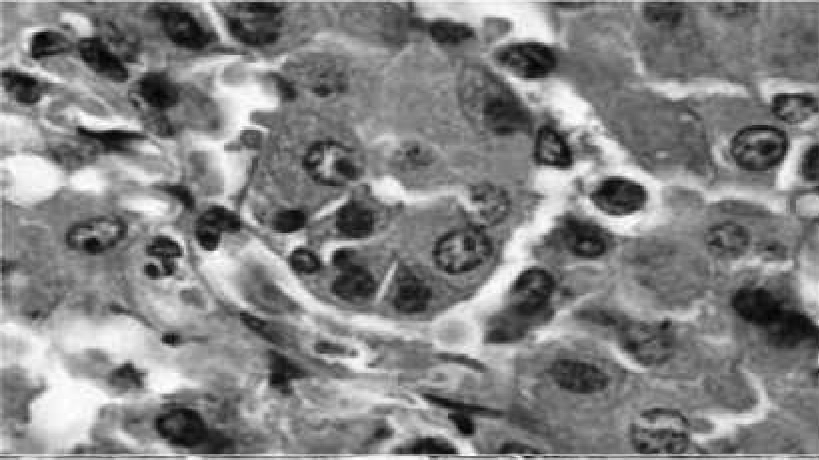
Рис. 6. Узел регенерации гепатоцитов, каликвационный некроз. Гематоксилин с эозином, 10x40
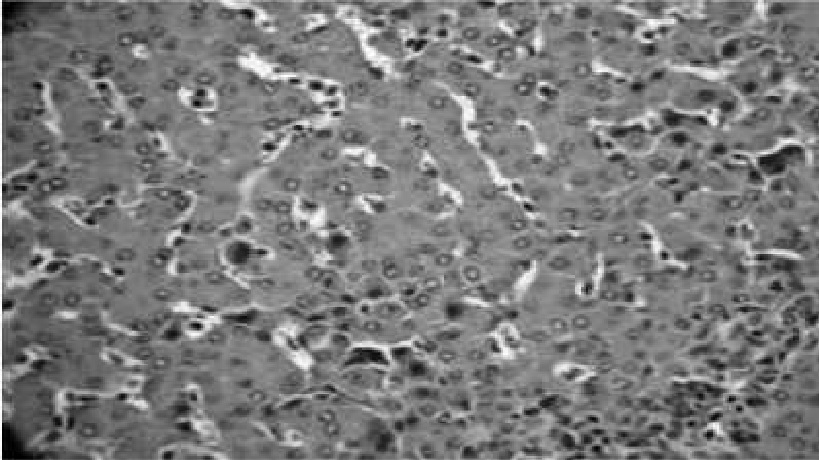
Рис. 7. Геалиновокапельная дегенерация, мононуклеарная инфильтрация синусов. Гематоксилин с эозином, 10x20
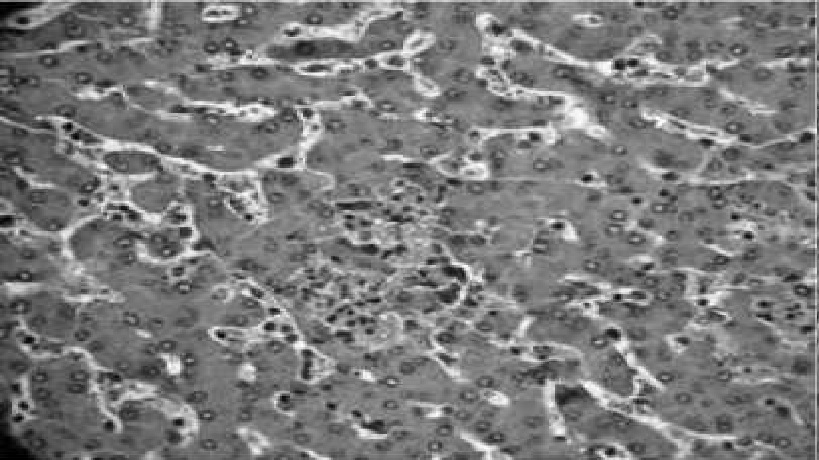
Рис. 8. Фокальные некрозы с инфильтрацией синусов и паренхимы лимфоцитами, гиперемия синусов. Гематоксилин с эозином, 10x10
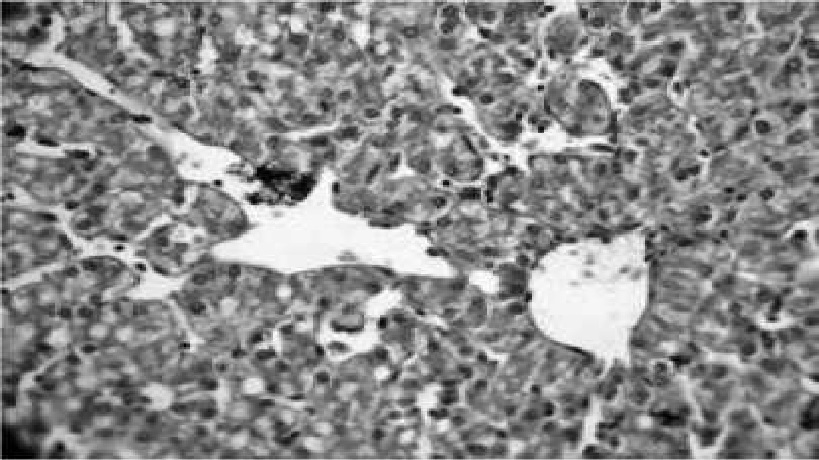
Рис. 10. Гидропическая и жировая дегенерация гепатоцитов, расширение синусоидов и центральной вены. Гематоксилин с эозином, 40x10
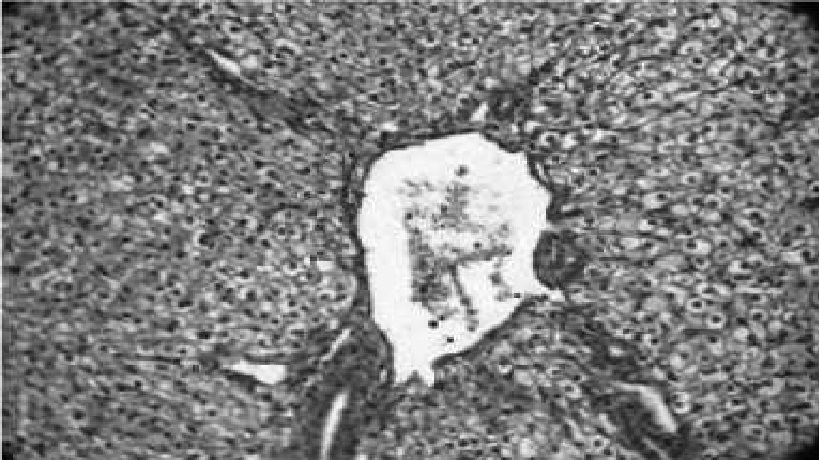
Рис. 11. Гидропическая дегенерация гепатоцитов, расширение центральной вены. Гематоксилин с эозином, 40x10
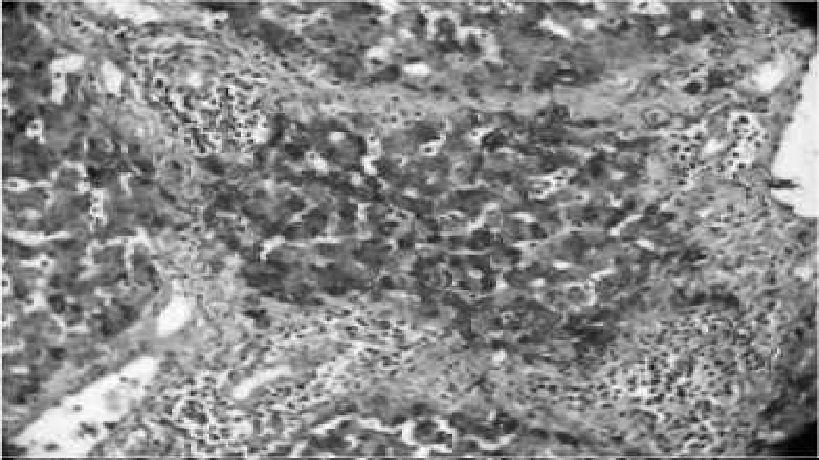
Рис. 12. Обширные лейкоцитарные инфильтраты, в гепатоцитах сохранен гликоген, ШИК 40x10
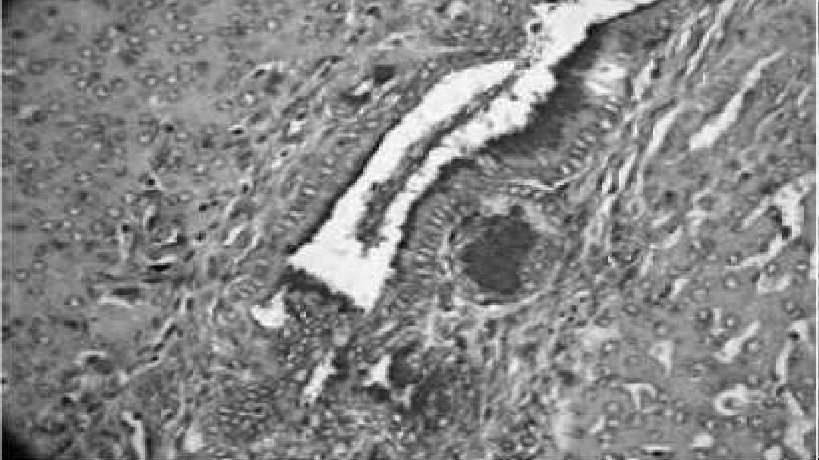
Рис. 13. Обширные лейкоцитарные инфильтраты, в гепатоцитах отсутствует гликоген, ШИК 40x10
журнал "Ветеринарная медицина" 1-2 2009