Е.А. Зеленуха'
ООО «Провими» (Москва).
А.А. Сидорчук
ФГБОУ «Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина».
Сокращения: АППС — актинобациллезная плевропневмония свиней, ВБА — вирус болезни Ауески, ВГС — вирус гриппа свиней, ИФА — иммуноферментный анализ, КРБС — комплекс респираторных болезней свиней, ПВИС — парвовирусная инфекция свиней, ПЦР — полимеразная цепная реакция, РКВС — рес-пираторный коронавирус свиней, РРСС —репродук-тивно-респираторный синдром свиней, ЦВИС — цир-ковирусная инфекция свиней, ЦВС-2 — цирковирус свиней-типа 2, ЭПС — энзоотическая пневмония свиней
Введение
Респираторные болезни свиней широко распространены во всех странах мира, в т. ч. России, и причиняют большой ущерб из-за высокой заболеваемости и летальности [6, 8, 10]. Эти болезни регистрируют в основном у 1,5...4-месячных поросят, наибольший отход наблюдают в 60.. .90-суточном возрасте, заболеваемость может достигать от 30 до 70 % а летальность — 40 %.
Среди возбудителей-инфекционных агентов выделяют большую группу вирусов и бактерий, а также в некоторых случаях ряд гельминтов [16, 21, 22]. Несколько обзоров, опубликованных по данному вопросу в последние годы, достаточно четко отображают картину этой патологии [1, 6, 7, 9, 16, 20].
Среди вирусов — первичных патогенов, вызывающих клинические признаки и поражение легких, в первую очередь надо отметить РРСС, ЦВС-2, ВГС, ВБА и РКВС [7, 9, 20]. Наибольшее значение, очевидно, имеют вирусы РРРС и ЦВС-2 [2, 3, 7, 9, 11].
Бактериальные респираторные патогены свиней так-же представляют весьма обширную группу. В первую очередь надо выделить Mycoplasma hyopneumoniae, Actinobacillus pleuiopneumoniae, Boidetella bron-chiseptica. Меньшее значение имеют Pasteurella mul-tocida, Haemophilus paiasuis, Streptococcus suis, Mycoplasma hyorhinus, Actinobacillus suis и др. [2, 5, 16, 19]. Таким образом, данную патологию можно характе-ризовать как полифакторную или полиэтиологич-ную [8, 10, 14, 17, 23].
Указанная патология получила название в мировой литературе КРБС [1, 7, 8, 12...16, 18...20, 22]. В частности, Кукушкин С.А. и др. (2008) указывают на широкое распространение и клиническое проявление КРБС в промышленных свиноводческих хозяйствах России.
Цель исследования
Изучить распространение, причины заболевания и возможные механизмы контроля КРБС на ряде крупных промышленных свиноводческих предприятий (свинокомплексов) с учетом технологий получения продукции свиноводства.
Материалы и методы
Базой для комплексных исследований послужили 4 крупных свинокомплекса России с полным замкнутым циклом технологического производства свинины. Эпизоотологические, клинические и патоло-го-анатомические исследования проводили комиссионно, с участием специалистов хозяйств. В процессе исследований отбирали пробы патологического материала от павших и вынужденно убитых животных; сыворотки крови, полученные от животных разных половозрастных групп (методом произвольной выборки), отправляли в лабораторию. Сыворотки крови получали, в основном, у свиноматок 1...8-го опоросов и поросят, в т. ч. больных и слабых, в возрасте 1...25 нед, а также хряков. Как правило, кровь брали от 5... 10 животных каждой половозрастной группы.
Базой для лабораторных исследований послу-жили специализированные лаборатории Федерального центра здоровья животных (г. Владимир). В лаборатории сыворотки крови на наличие специфических антител исследовали в ИФА со стандартными диагностическими наборами против вирусов РРСС, ЦВИС-2, ВБА и бактериальных патогенов. Пробы патологического материала (кишечника, селезенки, лимфоузлов, легких) от павших и вынужденно убитых свиней различного возраста, а также сперму хряков, пробы внутренних органов от абортированных плодов исследовали методом ПЦР на наличие геномов РРСС, ПВИС, ЦВИС-2, РКВС, ВБА и др., а также ряда бактериальных патогенов [М. hyopneumonia, М. hyorhinis, P. multocida, H. parasuis, A. pleurop-neumonia и др.).
Цель серологических исследований — подтвердить серопозитивность к основным специфическим и хозяйственно значимым вирусным и бактериальным болезням; определить сроки и пути заражения (го-ризонтальный и вертикальный), продолжительность колострального иммунитета, сроки вакцинопрофи-лактики; разработать эффективные схемы противо-эпизоотических мероприятий.
Кроме того, оценивали эффективность вакциноп-рофилактики основных вирусных респираторных болезней поросят при использовании вакцин отечественных и зарубежных производителей.
Результаты и обсуждение
Основные причины падежа молодняка в одном из изученных крупных свиноводческих хозяйств — респираторные и желудочно-кишечные болезни. У поросят в возрасте 30... 120 суток гибель по месяцам составляет от 400 до 1200 голов. В этой возрастной группе от 20 до 50 % животных проявляют признаки бронхопневмонии. Падеж свиней на откорме составляет от 30 до 500 гол./мес с основными проявлениями заболевания также в виде бронхопневмонии. Подъем заболеваемости и падежа при рес-пираторной патологии устойчиво наблюдается в осенне-зимний период. Падеж; среди взрослого продуктивного поголовья незначительный. Анализ падежа свиней на откорме по одному из отделений хозяйства за полугодие также свидетельствовал, что основной причиной гибели свиней служат поражения респираторной системы — более 60 % общего падежа. Основной отход поросят в подсосных группах отмечен в возрасте 2... 15 суток. У поросят групп доращивания — с 14-е по 35-е сутки пос-тановки в группы (т. е. в возрасте 45...65 суток).
При клиническом осмотре и патолого-анатомичес-ком вскрытии павших поросят различного возраста установлены признаки, характерные для заражения респираторными болезнями, — РРСС, ЦВИС, микоп-лазмозной (энзоотической) пневмонии, актинобацил-лезной пневмонии и гемофилезного полисерозита. Отмечены также другие признаки, свойственные инфекционным болезням свиней данного возраста, выходящие за рамки нашего исследования.
В результате лабораторных исследований получены, в частности, положительные результаты на РРСС, ЦВС-2, АППС, микоплазмы 2-х видов [М. hyopneumonia., М. hyorihnis), A. pleuropneumonia, H. parasuis. Причем в одном из хозяйств установлено цир-кулирование обоих генотипов возбудителя РРСС (европейского и американского). При исследованиях клинически здоровых поросят одной фермы геномы возбудителей РРСС, ЦВИС, РКВС, ЭПС, АППС, пас-терелл и гемофилов не обнаружены. А при исследовании аналогичных поросят с проявлением респира-торной патологии на другой ферме выявлен целый «букет» геномов вирусов РРСС европейского генотипа, ЦВИС-2, АППС, М. hyorhinis, пастерелл и гемофилов. Полученные результаты свидетельствуют о циркулировании на данной ферме возбудителей КРБС.
В другом случае исследования легких 102-суточ-ных поросят одной из ферм дало положительные результаты на вирус РРСС европейского генотипа, ЦВИС-2, возбудители ЭПС, гемофилеза и пастерел-леза. Аналогичные исследования 112-суточных поросят другой фермы дали положительные результаты на ЦВИС-2, АППС, микоплазмоз, гемофилез и пасте-реллез.
В дальнейшем (через 1,5 года после начала исследований) при использовании комплексной системы лечебно-профилактических мероприятий, включающих в себя вакцинацию против вирусных болезней и обработку животных против бактериальных патогенов, ситуация в хозяйствах стабилизировалась. Однако в ряде случаев после контрольного убоя и вскрытия поросят с признаками заболевания были установлены изменения легких, характерные для рес-пираторной формы РРСС, актинобациллезной пневмонии и воспаление лимфоузлов, что характерно для поражения ЦВС-2. В частности, при исследовании легких от 75-суточных поросят обнаружены геномы вируса РРСС (европейского генотипа), ЦВИС-2, ми-коплазм и гемофилов. Полученные результаты сви-детельствуют о неполной эффективности проведенных противоэпизоотических мероприятий.
При исследовании поросят 1...25-недельного возраста, матери которых были двукратно привиты живой вакциной протии РРСС, было отмечено: специфические антитела против РРСС обнаруживаются у поросят до 4-недельного возраста, что характерно для пассивного иммунитета, затем практически исчезают и вновь появляются с 10-недельного возраста и сохраняются до 25 недель (срок исследований), что свидетельствует о перезаражении животных в указанный период.
При этом результаты серологических исследований после вакцинации против РРСС и ЦВС-2 показали достаточно высокие титры антител, что свидетельствует об эффективности иммунизации. Титры антител к ЦВС-2 в сыворотках крови вакцинированных свиней также были достаточно стабильные (соответствующие положительному результату вакцинации) хотя и не очень высокие. Однако при этом отмечена возможная циркуляция полевого вируса в поголовье.
Высокое содержание антител против возбудителя АППС свидетельствовало о циркуляции возбудителя в стаде и передаче его от свиноматок поросятам. Необходимы дальнейшие исследования, чтобы определить стратегию борьбы с данной инфекцией, включая вакцинопрофилактику.
В связи с результатами серологических иссле-дований применение вакцинации против РРСС и ЦВС-2 оправдано. При вакцинации против РРСС необходимо учитывать не только оптимальные сроки иммунизации, органично вписываемые в технологию выращивания свиней, но также и сам биопрепарат. Свиноматок основного стада можно достаточно эффективно предохранять с использованием инактивированных вакцин. Весьма хорошие результаты были получены при использовании инактивированнои вакцины производства ВНИИЗЖ или «Прогрессис» производства компании «Мери-ал» (Франция). При этом наиболее эффективной оказалась схема вакцинации свиноматок на 65-е сутки после осеменения и на 10-е сутки после опороса, с последующим отъемом поросят на 26...28-е сутки. Ремонтных свиноматок целесообразно прививать живой вакциной двукратно, на 170-е и 190-е сутки с последующей ревакцинацией инактиви-рованным препаратом на 65-е сутки после осеменения. Из живых вакцин выраженный эффект получен при использовании вакцин «Порцилис РРСС» компании «Интервет» и «Амервак РРСС» компа-нии «Хипра» (Испания). Оба биологических препарата по эффективности примерно одинаковы, разница лишь в эффективности при циркуляции американского типа РРСС и в стоимости.
При вакцинации против ЦВИС-2 могут быть использованы вакцины «Порцилис PCV» компании «Интервет» или «Цирковак» компании «Мериал», двукратно, в возрасте 1 и 3 нед. Для этих целей может также быть предложена однократная вакцинация поросят вакциной «ЦиркоФЛЕКС» компании «Бе-рингер ».
В случае применения вакцинации против бактериальных патогенов хорошие результаты получены в неблагополучных по заболеванию хозяйствах, где с профилактической целью для иммунизации свиней против АППС, вызываемой Actinobacillus pleurop-neumonia, применяли вакцины «Коглапикс», производства «Сева Анималь» (Франция) и «Порцилис Арр» производства компании «Интервет». С этой целью следует прививать поросят групп доращива-ния в возрасте 40...42 суток, двукратно с интервалом 2 нед. В этом случае хороший иммунный ответ у поросят вырабатывается через 21 день после повторного введения вакцины, т. е. примерно к 3,5 мес жиз-ни. Необходимо также решать вопрос о профилактике и контроле микоплазменных инфекций, по отношению к которым в нашей стране вакцинация не применяется.
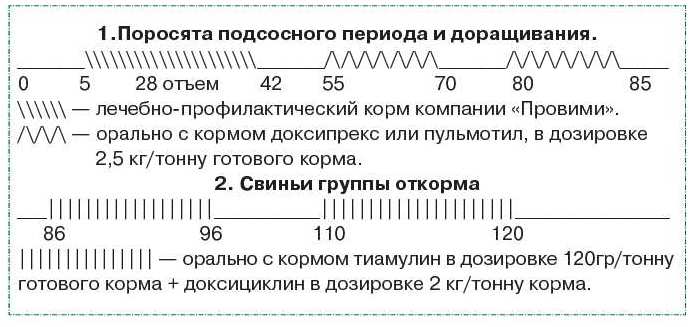
В качестве лечебно-профилактического средства против бактериальных патогенов могут использоваться лечебно-профилактический корм компании «Прови-ми» в период отъема (в течение 35 суток), а также антибактериальные препараты «Доксипрекс», «Пульмотил», «Тиамулин» по приведенным схемам.
Схемы антибактериальной терапии свиней
Выводы
В исследованных свиноводческих предприятиях выявлен КРБС, вызываемый вирусами РРСС и ЦВС-2, а также бактериями М. hyopneumonia, M. hyori-hnis., A. pleuropneumonia, H. paiasuis, P. multoci-da, который приносит существенные потери при вы-ращивании поросят. Наибольшие заболеваемость и отход поросят от респираторных болезней отмечены в периоды отъема и доращивания. Подъем заболеваемости и падежа поросят от респираторной патологии устойчиво наблюдают в осенне-зимний период.
Результаты диагностических исследований подтверждают необходимость постоянной плановой иммунизации свинопоголовья против РРСС и ЦВИС. Кроме этого, в системе профилактических, противоэпи-зоотических мероприятий необходимы эффективные антибактериальные препараты для профилактики вторичных бактериальных инфекций.
Иммунизацию против РРСС с использованием различных вакцин (живых и инактивированных) в целом следует признать эффективной, как в плане создания активного иммунитета у животных, так и пассивного (молозивного), несмотря на то, что полностью исключить циркуляцию возбудителя инфекции среди свинопоголовья невозможно. Вакцинация против ЦВИС и АППС также способствует снижению проявления респираторной патологии и должна проводиться с учетом возраста свиней и технологии про-изводства.
Библиография
1. Бочев И. Комплекс респираторных болезней свиней: обзор. 1. Этиология, эпизоотология, клинические формы и патологоанатомические черты // Российский ветеринарный журнал. Сельскохозяйственные животные, 2008; 1:16—20.
2. Грибов Ю.А., Клюкина В.И., Моисеева Н.А.. Репродуктивно-респираторный синдром свиней и цирковирусная инфекция свиней: Проблема двух систем.//Тезисы докладов Международной конференции «Научные основы производства ветеринарных биологических препаратов». — Щелково, 2005.
3. Кукушкин С.А., Байбиков Т.З., Рахманов A.M., Русалеев B.C.. Смешанное течение репродуктивно-респираторного синдрома свиней (РРСС) в ассоциации с вирусными и бактериальными инфекциями // Мат-лы учред. конф. Междунар. ассоциации паразитоценологов. — Витебск, 1999.
4. Кукушкин С.А., Байбиков Т.З., Тимина A.M., Челышева М.З., Ковалишин В.Ф. Изучение комплекса респираторных болезней свиней в свиноводческих хозяйствах России // Российский ветеринарный журнал. Сельскохозяйственные животные, 2008; Спец. вып., посвящен. 50-летию ФГУ «ВНИИЗЖ»: 55—57.
5. Кукушкин С.А Особенности течения и вакцинопрофилактика репродуктивно-респираторного синдрома свиней: автореф. дис....докт. вет. наук. — Владимир, 2009.
6. Оганесан А.С., Дудников С.А., Бъядовская О.П., Прохватилова Л.Б. Комплекс респираторных болезней свиней: факторный анализ и первичная модель заболевания // Ветеринарная патология, 2009; 4: 28—38.
7. Орлянкин Б.Г., Алипер Т.И., Непоклонов Е.А.. Инфекционные респираторные болезни свиней: этиология, диагностика и профилактика // Ветеринария, 2005; 11:3—6.
8. Орлянкин Б.Г., Алипер Т.И., Непоклонов Е.А. Инфекционные респираторные болезни свиней // Промышленное и племенное свиноводство, 2006; 1: 52.
9. Орлянкин Б.Г., Гребенникова Т.В., Алипер Т.И., Мишин A.M. Специфическая профилактика репродуктивно-респираторного синдрома свиней // Свиноводство, 2010; 3: 67—69.
10. Шахов А., Ануфриев А., Ануфриев П. Факторные инфекции свиней//Животноводство России, 2004; 3: 22—24.
11. Щербаков А.В., Ковалишин В.Ф., Яковлева А.С., Шабаева Г.В., Этиологическая структура инфекционных болезней свиней в животноводческих хозяйствах России / Актуальные проблемы инфекционной патологии животных//Мат-лы Межд. науч.-практ. конф., посвящ. 45-летию ФГУ «ВНИИЗЖ». — Владимир,2003.
12. Dee S.A. Porcine respiratory disease complex: "The 18 week wall."// Proc. Am. Assoc. Swine Pract.,1997.
13. Done S.H. Porcine respiratory disease complex (PRDC) // The Pig Journal, 2002; 50:174—196.
14. Grau-Roma L, Segales J.. Detection of porcine reproductive and respiratory syndrome virus, porcine circovirus US type 2. swine influenza virus and Aujesky's disease virus in cases of porcine proliferativeand necrotizing pneumonia (SNP) in Spain//Vet. Microbiol., 2007; 1 (19):144—151.
15. Groschup M.H, Brun A, Haas B. Serological studies on the potential synergism of porcine reproductive and respiratory syndrome virus and influenza-, corona- and paramyxoviruses in the induction of respiratory symptoms in swine//J Vet Med., 1993; 40: 681—689.
16. Halbur P.G. Porcine viral respiratory disease // Proc. 15 Int. Pig Vet. Soc.Congr, 1998.
17. Kamogawa 0., Tomiia Y., Kaneko M., Yamada S., et al. Isolation of porcine respiratirycoronavinis Irorn svndrome//J.Vet.Med.Sci., 1999; 58 (4): 365—366.
18. Kim J., Chung H.K., Chae С Association of porcine circovirus 2 with porcine respiratory disease complex // Vet. J., 2003; 166 (3): 251—256.
19. Kohne K., Huebert P. Mixed respiratory infections associated with the porcine respiratory disease complex detected with multiplexPCR// Proceeding of the 19th Int. Congress on Pigs Veterinary Society, 2006.
20. Scheidt A. Control of viral respiratory diseases // Proc. 15th IPVS Congress, 1998.
21. Stevenson G.W. Bacterial pneumonia in swine // Proc. 15th IPVS Congress, 1998.
22. Thacker E.L. Immunology of the porcine respiratory disease complex // Vet. Clin. North Am. Food Anim. Pract., 2001; 17 (3): 551—565.
23. Van Reeth K, Nauwynck H, Pensaer M.B. Dual infections of feeder pigs with porcine reproductive and respiratory syndrome virus followed by porcine respiratory coronavirus or swine influenza virus: a clinical and virological study // Vet Microbiol., 1996; 48:325—335.
журнал "Российский ветеринарный журнал" №2 2012