И. Ф. Вилковыский, к.в.н, И. А. Шевченко, А. В. Чернявская, А. В. Каменева, С. Б. Селезнев, профессор, Ю. А. Ватников, профессор
Введение
Опухоли ротовой полости занимают 5-6% от всех опухолевых новообразований (5, 6, 7). Симптомы, при которых необходимо помнить об онкологической настороженности: гиперсаливация, галитоз, кровотечения из ротовой полости, деформация челюсти, асимметрия лицевой части черепа, расшатывание или выпадение зубов, затрудненный прием пищи, нарушение функции дыхания.
Диагностика опухолей ротовой полости включает в себя: осмотр (размеры опухоли, локализацию, степень инвазии, состояние регионарных лимфатических узлов), визуальные методы диагностики (рентгенография челюсти и/или черепа, КТ и МРТ), исключение отдаленных метастазов (рентгеновское исследование грудной клетки, УЗИ брюшной полости), исследование морфологического типа опухоли (открытая биопсия или трепанбиопсия).
Показанием к проведению операции может быть наличие доброкачественной или злокачественной опухоли, сложные застарелые переломы челюсти и т.д. Нередко в последствии операции образуются значительные дефекты костей нижней челюсти, сопровождающиеся дефектами окружающих мягких тканей (1, 2, 3, 4). Эти дефекты требуют проведения операции по реконструкции челюсти. Актуальность данного вопроса заключается в необходимости создания для животного возможности самостоятельно принимать корм и воду, тем самым обеспечивая относительную автономность, что в свою очередь улучшит качество жизни самого животного и облегчит уход за ним для владельца.
Также важно помнить об эстетическом аспекте: умело реконструированная челюсть в совокупности с наличием шерстного покрова может обеспечить большое сходство с естественным видом животного.
Материалы и методы
В гуманной медицине в целях реконструкции нижней челюсти получили широкое использование следующие материалы (1,2):
а) реконструктивная пластина, прикрепляемая к краям дефекта;
б) аутотрансплантат, представляющий собой лоскут костной ткани вместе с питающими его сосудами; неваскуляризированный аутотрансплантат;
в) аллотрансплантат или ксенотрансплантат. Реконструктивная пластина отвечает требованиям, предъявляемым к остеопластическим материалам. В последние годы в медицине нашли довольно широкое применение биологически инертные конструкции изтитана. Основным недостатком данного метода большинство авторов считает срок службы таких пластин,

который ограничен двумя - тремя годами, - появление трещин зависит от времени и нагрузки. Стальные пластинки применяют при реконструкции челюсти пациентов, неспособных перенести тяжелую операцию по пересадке свободного лоскута костной ткани вместе с питающими его кровеносными сосудами.
Трансплантация пластинки пациентам, у которых отсутствует центральная часть челюсти, категорически противопоказана из-за большой нагрузки, которая ложится на пластинку.
Наиболее подходящим решением в гуманной медицине является трансплантат, представляющий собой лоскут костной ткани вместе с питающими его сосудами. Совместно с костной тканью существует возможность пересадки мягких тканей для восстановления мышц языка и дефектов кожи. Донорский участок, как в физиологическом плане, так и в эстетическом не страдает в дальнейшем. Для трансплантации свободного лоскута костной ткани можно использовать трансплантаты, взятые из малой берцовой кости (сосудистая ножка представлена нижними коленными нисходящими сосудами или ветвями передних больше-берцовых сосудов), из костной ткани лопатки (ветви подлопаточных сосудов), подвздошной кости (поверхностные или глубокие огибающие подвздошную кость сосуды) или ребра (межреберные сосуды), вместе с соответствующими материалами мягких тканей для последующего покрытия костного и мплантата. В этих случаях дисфункция и эстетические проблемы также мини-мальны. Доказано, что васкуляризированные трансплантаты создают более благоприятные условия для выживаемости остеогенных клеток. Блок мягких и костных тканей пересаживают в подготовленное в месте дефекта костное ложе и воссоздают его кровоснабжение с помощью микрохирургических манипуляций. Соединенные артериальные и венозные сосуды обеспечивают адекватное кровоснабжение, как трансплантата, так и воспринимающего ложа. Известны пересадки вышеперечисленных костных фрагментов без сосудистого начала. При этом васкуляризация фрагмента происходит за счет окружающих мягких тканей и костно-мозгового канала.
Алло- и ксенопластика. В отличие от аутопластического материала клеточные элементы алло- и ксенотрансплантатов при пересадке всегда погибают. Мертвая кость фактически становится инородным телом, реакция на которое определяется различиями в антигенной структуре белков, образующих вещество трансплантата и ткани воспринимающего ложа, а также состоянием иммунной системы организма. Процессы перестройки алло- и ксенотрансплантатов сопровождаются инвазией сосудов и образованием новой кости, но лишь за счет клеток окружающих тканей. Скорость этих процессов во многом определяется размерами и структурой трансплантатов; она наиболее высока при использовании трансплантатов минимального размера (костная щебенка, костная стружка).
Аллогенный деминерализованный костный трансплантат играет роль органической внеклеточной матрицы, которая вызывает остеогенез с костного ложа.
Сначала образуется незрелая хрящевая ткань, а затем, благодаря деятельности остеобластов начинается построение нормальной костной ткани. В процессе остеогенеза наиболее активны кортикальные аллотрансплантаты, так как в этом веществе кости больше костного протеина. Деминерализованные аллотрансплантаты выделяют такого протеина больше, чем недеминерализованные. Новые технологии в подготовке аллокостных тканей - деминерализованного костного матрикса, костного морфогенетического протеина позволяют повысить эффективность использования этих материалов для пластики при имплантации.
Установлено, что в остеогенезе деминерализованных трансплантатов большое значение имеет васкуляризация того участка кости, где поставлен имплантат и подсажена кость. ,
При выраженном кислородном голодании аллотрансплантатов образуется не кость, а фиброзная или хрящевая ткань, что может отрицательно сказаться на приживлении имплантата. Аллотрансплантаты деминерализованной и лиофилизированной кости имплантируют, применяя те же методики, что и при использовании аутокости.
Однако методы с применением алло- и аутотрансплантатов имеют ряд недостатков:
1) одномоментное устранение дефекта нижней челюсти после удаления опухоли с использованием биотрансплантата не всегда возможно;
2) тенденция трансплантата котторжению и инкапсуляции;
3) рассасывание костного трансплантата;
4) использование аутотрансплантата сопряжено с дополнительной травмой для пациента;
5) использование аллотрансплантатов предполагает наличие доступного банка таких тканей и в тоже время не снижает проблемы тканевой несовместимости;
6) трудоемкий процесс при аутотрансплантации (одновременно проводятся 2 операции).
На основании вышеизложенного материала, по нашему мнению, использование реконструктивной пластины для замещения дефектов нижней челюсти предпочтительнее вследствие следующих факторов:
• Доступность (материалы для проведения Общедоступны);
• Относительно несложная техника выполнения операции;
• Надежная фиксация костей нижней челюсти;
• Срок службы пластины является достаточно продолжительным относительно срока жизни животного;
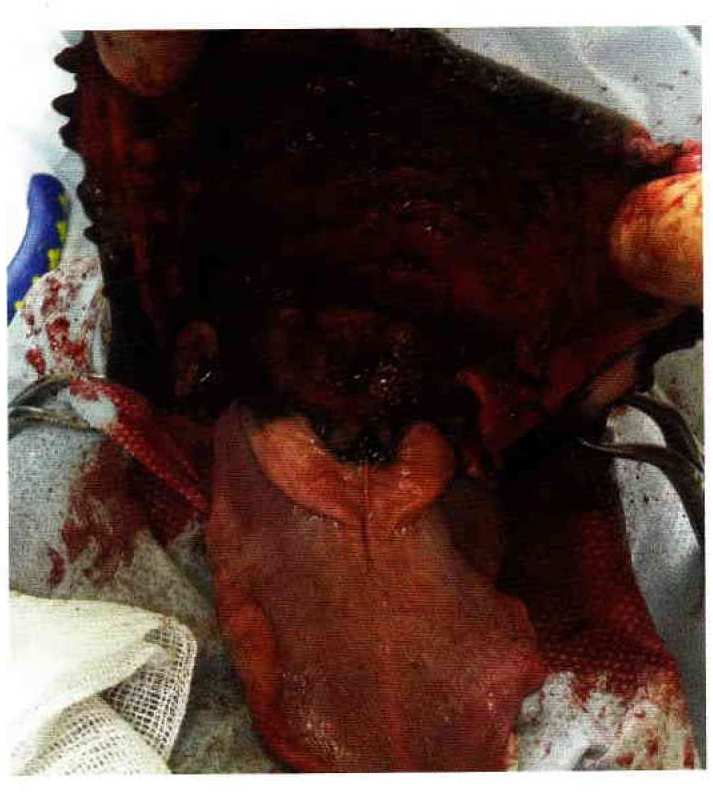
Рис.6
• Обеспечение полноценного функционирования ротового аппарата (самостоятельный прием корма, воды, отсутствие саливации).
За последние два года, на базе ветеринарных клиник «Биоконтроль», «Квина» и «Медвет», было прооперировано 7 животных по поводу новообразований челюсти различного объема и различного морфологического строения с последующим использованием реконструкции нижней челюсти. Одно животное, после нескольких неудачно проведенных остеосинтезов, наблюдалось в другом лечебном учреждении с последующим остеолизисом правой и левой горизонтальных ветвей нижней челюсти, Реконструкцию нижней челюсти применяли только в тех случаях, когда после операции животное не могло самостоятельно принимать корм и воду, а также при выраженных внешних эстетических дефектах челюсти. Для реконструкции применяли биосовместимые титановые пластины и винты компании ООО «Конмет», изготовленные специально под размер и вес животного, а также в зависимости от размера замещаемого дефекта. После резекции челюсти необходимого объема и оценки образовавшегося дефекта применяли реконструктивную титановую пластину, придав ей необходимую форму и выбрав необходимую длину. Фиксировали пластину к оставшимся участкам нижней челюсти, по возможности, тремя винтами. Заключительный этап является одним из самых важных и сложных. Укрытие импланта мягкими тканями с использованием пластической хирургии необходимо выполнять самым тщательным образом. В послеоперационном периоде использовалась диета послеоперационного восстановления.
Результаты
Наиболее частым осложнением является расхождение швов, попадание частиц пищи в послеоперационную область, инфицирование пластины.
По нашему опыту у двух собак (28%) в связи с вышеописанными осложнениями пришлось пластину удалить. Причем, в одном случае собака была агрессивная, и неправильно выбранный владельцем животного размер воротника и отсутствие санации швов привели к полному расхождение шеов. Все последующие попытки изменения дефектов оказались безуспешными и, в дальнейшем, пластина была удалена.
В остальных случаях результаты операции расцениваются как удовлетворительные. У двух собак (28%) развился послеоперационный дефект слизистой оболочки ротовой полости и ряд повторных пластических операций позволил полностью закрыть.дефект. У трех собак (43%) осложнений не было. На сегодняшний день наиболее длительный период нахождения пластины составляет 1,5 года и собака до сих пор активно и самостоятельно принимает пищу.
Клиническая картина
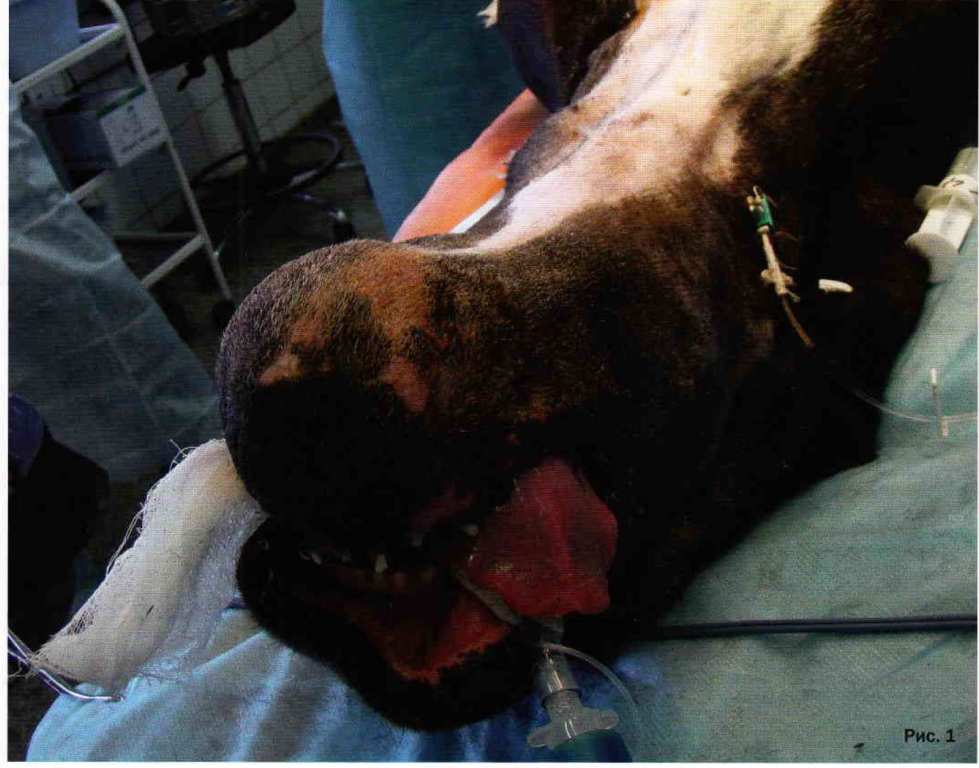
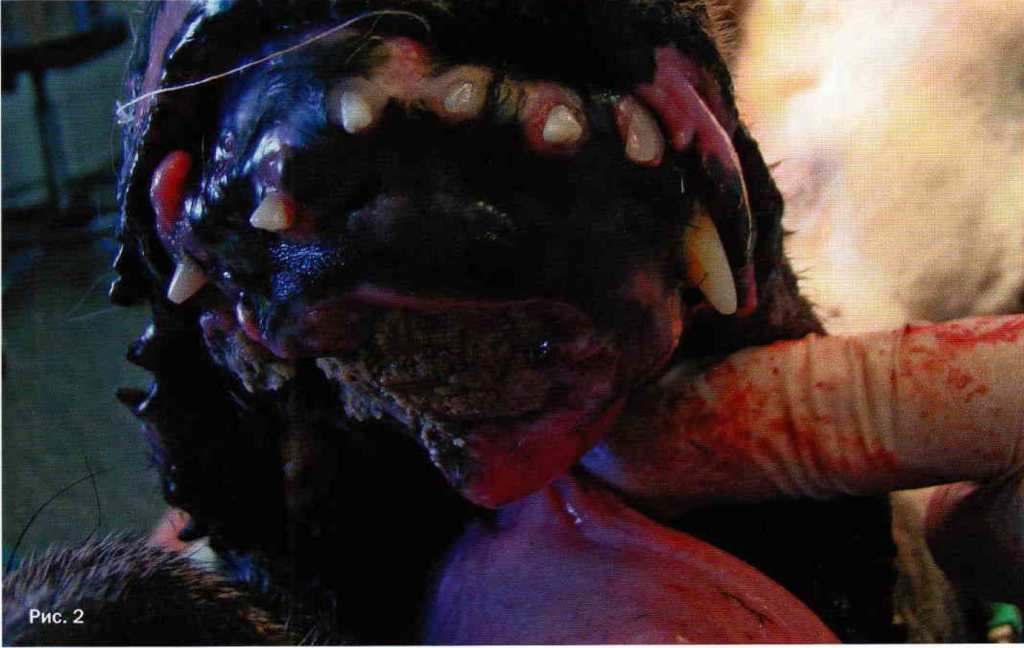
Собака породы канекорсо, самка 9 лет. Поступила в клинику с новообразованием нижней челюсти. В результате обследования поставлен диагноз фибросаркома нижней челюсти с остеодеструкций правой и левой горизонтальных ветвей нижней челюсти (фото 1, 2). Гамма-терапия с химиотерапией ожидаемого эффекта не принесла. Выполнена резекция челюсти по последние моляры с правой и левой стороны с последующей реконструкцией биосовместимой титановой пластиной (фото 3}. На фото 4 показана собака через 1,5 года после операции.
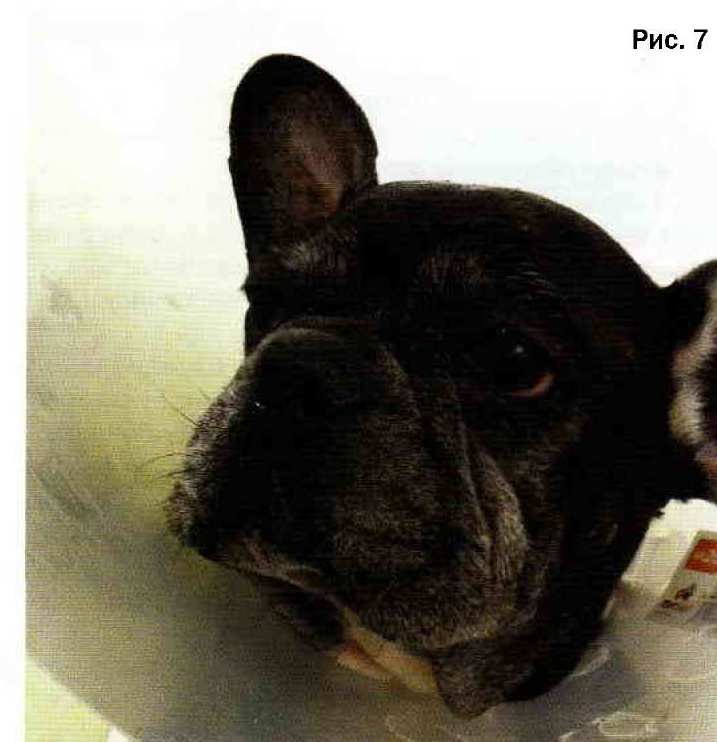
Собака породы французский бульдог, 8 лет. Поставлен диагноз плоскоклеточный рак нижней челюсти с остеодеструкцией правой и левой горизонтальных ветвей нижней челюсти (фото 5). Выполнена резекция нижней челюсти, включая все зубы до угла нижней челюсти (фото 6). Ранний послеоперационный период протекал без осложнений. В день снятия швов состояние удовлетворительное (фото 7}. Самостоятельный прием корма через сутки после операции. На сегодняшний день время от начала лечения - 2 месяца.
Обсуждение
Таким образом, данное направление, по нашему мнению, очень перспективно. Большому количеству животных проводилась лучевая терапия или регионарная химиотерапия в качестве симптоматической терапии или отказывалось в проведении лечения вследствие большого размера опухоли.
На сегодняшний день этим животным возможно оказать адекватную помощь. При этом оценка качества жизни и внешнего вида животных после операции проводится врачом и владельцами собак-компаньонов и в большинстве случаев является положительной.
К сожалению, сейчас нет возможности оценить отдаленные результаты лечения с точки зрения сроков службы имплантов у животных, но уже имеющиеся результаты дают возможность развивать это направление и внедрять его в практику ветеринарного врача.
Литература
1} Белоусов А. Е.. Альтшулер М, Д, Брагилев В. Л. и др. "Пластическая реконструктивная и эстетическая хирургия" , Гиппократ, 1998 г.
2) Федяев И. М., Байриков И. М., и др. "Злокачественные опухоли челюстно-лицевой области" Москва, Медицинская книга, 2000 г.
3) Шебиц, X., Брасс В. "Оперативная хирургия собак и кошек", Аквариум, 2007 г.
4) Уайт R "Онкологические заболевания мелких домашних животных", Аквариум, 2003 г.
5) Daniel J. Brockman Canine and feline head, neck and thoracic surgery", BSAVA, 2005 r.
6) Jane M. Dobson Canine and feline oncology, second edition, BSAVA, 2003 r.
7) Withrow S, et all, Small animal clinical oncology, fourth edition, Canada, 2007 r.
VETPHARMA №1-2 МАРТ 2012