Нечаева Т. А.
ГБУ Республики Карелия «Республиканская ветеринарная лаборатория»
Введение
Выращивание рыбы в установках с замкнутым циклом водоснабжения (УЗВ) яв-ляется одной из наиболее перспективных технологий аквакультуры. С ростом инду-стриализации в форелеводстве особенно актуальным становится использование УЗВ для выращивания молоди форели.
Это позволяет в хозяйствах-репродукторах в короткие сроки получить рыбу с не-обходимой навеской для последующей ее реализации в выростные хозяйства, а также сократить сроки выращивания племенной молоди. УЗВ дают возможность более экономично использовать водные ресурсы предприятия, а также применять подогрев воды. При этом моноцикличная технологическая схема получения молоди заменяется полицикличной, что способствует многократному увеличению производства посадочного материала. В результате предприятие может получить большие объемы продукции за сравнительно короткий промежуток времени.
В то же время возрастает риск бактериальных заболеваний и токсикозов, особенно в первые годы эксплуатации УЗВ. В условиях замкнутой системы количество всех групп микроорганизмов, как правило, возрастает на несколько порядков по сравнению с содержанием их в естественных водоемах [2]. При попадании в установку с рециркулируемой водой рыбы, обсемененной условно-патогенными микроорганизмами, уровень накопления бактериального агента быстро возрастает и включается механизм водной передачи его здоровым особям. В условиях тесного контакта скорость передачи потенциального возбудителя очень высока [5, 6].
Использование антибиотиков в таких системах ограничено из-за возможного негативного воздействия на микрофлору биофильтров УЗВ.
Таким образом, возникает необходимость в препаратах, которые, способствуя поддержанию оптимального физиологического состояния рыб, были бы безвредны для микробиоценоза биофильтра. Пробиотики удовлетворяют этим требованиям благодаря своей способности подавлять рост и развитие патогенной и условно-патогенной микрофлоры, повышать обменные процессы и защитные реакции организма, активизируя клеточный и гуморальный иммунитет.
К группе пробиотиков относятся препараты серии Ветом, созданные на основе спорообразующих бактерий Bacillus subtilus и Bacillus licheniformis. За последнее время накоплен некоторый положительный опыт использования в рыбоводстве препарата Ветом 1.1. Было отмечено стабильное улуч-шение эпизоотического и физиологиче-ского состояния рыб после перенесенного стресса, токсикоза, при хроническом течении бактериальной инфекции (миксобакте-риоз). Во всех случаях отмечено ускорение регенерационных процессов и улучшение состояния крови при использовании препарата Ветом 1.1 [8].
Целью нашей работы являлось дальней-шее изучение препаратов серии Ветом на физиологическое и эпизоотическое состоя-ние рыб при выращивании в УЗВ.
Материал и методы исследования
Исследовательская работа была проведена на базе ФГУП Федеральный селекционно-генетический центр рыбоводства (ФГУП ФСГЦР), Ленинградская область.
Молодь радужной форели с навеской от 4,3 до 15,3 г, содержащаяся в УЗВ, регулярно подвергалась ихтиопатологическому обследованию.
Температура воды за период наблюдения составляла от 18 до 12 °С.
Ихтиопатологическое обследование проводили по методике Быховской-Павловской [1]. Микробиологические исследования были проведены в Ленинградской межобластной ветеринарной лаборатории (Санкт-Петербург). Диагностирование миксобактериоза в полевых условиях про-водили по экспресс-методу Люмсден [10].
О физиологическом состоянии рыб судили по состоянию форменных элементов крови. Окраска мазков крови проведена по методу Романовского.
Гидрохимические исследования проведе-ны в лаборатории экологической токсикологии ГосНИОРХ. Температура воды в период выращивания рыбы изменялась от 9-18 °С.
Подопытная и контрольная группы были сформированы из сеголетков племенной радужной форели, содержащихся в бассейнах УЗВ. Средняя навеска рыб в подопыт-ной группе в начале опыта составляла 4,9 г, численность рыб в группе была 22 968 шт. Средняя навеска рыб в контрольной группе в начале опыта составляла 4,3 г, численность рыб в группе была 24 486 шт.
Рыбы перенесли токсическое воздействие, на фоне которого наблюдали клинические признаки бактериального холодноводного заболевания. Наблюдения за рыбами подопытной и контрольной групп были начаты при первых признаках токсикоза за 12 дней до начала опыта.
Ведение препарата Ветом 1.1 сеголеткам форели подопытной группы проводили в течение 10 дней в профилактической дозировке 50 мг/кг корма с добавлением аскорбиновой кислоты (1,5 г/кг корма). Курс лечебно-профилактического кормления был проведен в течение 10 дней.
В контрольной группе рыбам в течение 10 дней в корм вводили только аскорбиновую кислоту (1,5 г/кг корма), что является стандартным методом профилактики при стрессовой ситуации, применяемым в рыбо-водстве. Курс лечебно-профилактического кормления был проведен в течение 10 дней.
Антибиотики не применяли.
Результаты исследования
За 12 дней до начала лечебно-профилак-тического кормления нами было отмечено повышение отхода у сеголеток форели, со-держащихся в УЗВ.
В предшествующий период у рыб контрольной и подопытной групп были выявлены признаки токсикоза: гиперимированные и увеличенные в объеме почки, ослизненные, отекшие жабры. У отдельных особей отмечено нарушение координации движении и клонические судороги боковой мускулатуры. При нормальном содержании кислорода в воде (10-11 мгО/л) у рыб наблюдались явные признаки гипоксии - оттопыренные жабры, учащенное дыхание.
Гидрохимическое исследование воды показало значительное повышение ПДК по нитритам (0,45 MrN/л при нормативе 0,02 MrN/л) и фосфатам (0,11 мгР/л при нормативе 0,02 мгР/л). В мазках крови у форели обоих групп отмечено наличие большого числа незрелых безъядерных эритроцитов, разрушение эритроцитов - «ядерные тени», что характерно для рыб, подвергшихся токсическому воздействию [3, 4]. Наблюдаемая нами гипоксия развивается вследствие на-рушения эритропоэза, вызванного токсическим воздействием.
В дальнейшем у сеголеток контрольной и подопытной групп наблюдали клинические признаки миксобактериоза - анемию внутренних органов (печени и почек), анемию жабр, увеличение селезенки. В некоторых случаях селезенка больных рыб имела признаки фиброзного воспалительного про-цесса и была покрыта беловатым налетом. У 80 % рыб подопытной группы отмечено некротическое поражение спинного плавника. В ходе проведенных микробиологических исследований был выявлен возбудитель бактериального холодноводного заболевания -Flavobacterium psychrophilum (Flexibacter psychrophilus).
Так как обострение бактериальной инфекции проявилось на фоне токсического поражения, можно предположить, что именно токсикоз явился первопричиной ухудшения эпизоотического состояния сеголеток контрольной и подопытной групп. Подобное сочетание может сопровождаться высокими отходами рыб и затруднениями в постановке диагноза [9].
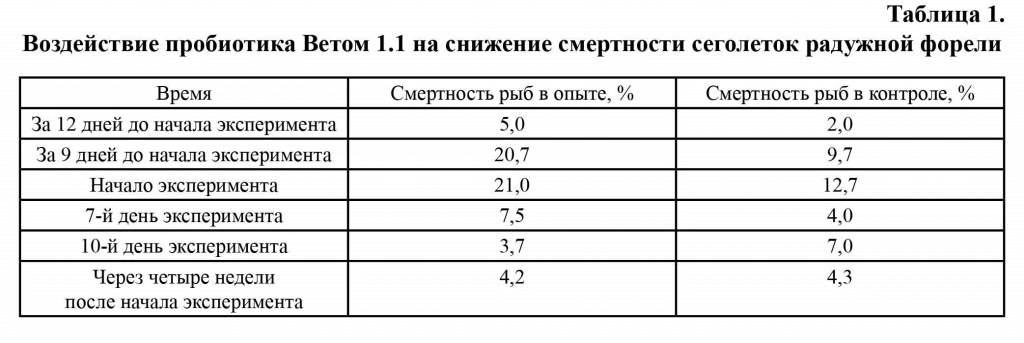
В начале наших исследований за 12 дней до постановки опыта гибель рыб составляла в подопытной группе - 5 %, в контрольной группе - 2 % (рис. 1). Тогда же были при-няты меры по нормализации работы УЗВ и прекращению токсического воздействия на молодь форели. Тем не менее через 9 дней отход сеголеток возрос в подопытной группе до 20,7 %, а в контрольной группе - до 9,7 % (рис. 1). К началу опыта в обеих группах наблюдался повышенных отход молоди форели с клиническими признаками токсикоза и бактериальной инфекции.
На седьмой день проведения опыта отход в подопытной группе снизился до 7,5 % за 10 дней, а в контрольной - до 4 %. В подо-пытной группе отмечена нормализация со-стояния эритроцитов. В контроле продолжают наблюдаться проявления эритропоэза.
По окончании 10-дневного курса лечения наблюдение за состоянием рыб в подопытной и контрольной группах были продолжено. Отход в подопытной группе снизился до 3,7 % в течение 10 дней со дня окончания опыта, а в контрольной, наоборот, увеличился до 7 % в течение 10 дней со дня окончания опыта (рис. 1). Состояние внутренних органов у рыб подопытной группы значительно лучше. У них не выявлена анемия жабр и внутренних органов, увеличение селезенки в отличие от молоди из контрольной группы.
К концу наблюдений через четыре недели после начала опыта отход рыб в подопытной группе составлял 4,2 %, а в контрольной -4,3 % в течение 10 дней (рис. 1).
Навеска сеголеток форели в подопытной группе в конце опыта составила 15,3 г, а в контроле - 13,7 г (рис. 2).
Результаты воздействия препарата - снижение смертности рыб в опыте по сравнению с контролем - представлены в таблице 1.
В обеих группах наблюдали восстановление нормальной картины крови. Состояние эритроцитов в мазках крови соответствует норме. В подопытной группе наблюдали регенерацию поврежденных спинных плавников.
Обсуждение результатов
Для опыта и контроля в нашей работе были взяты две группы рыб с приблизительно одинаковой навеской и в одинако-вом количестве. Однако их эпизоотическое состояние несколько различалось. У подопытных рыб оно было значительно хуже. В начале наблюдений их гибель в 2,1-2,5 раза превышала гибель рыб в контрольной группе, у них было отмечено некротическое по-
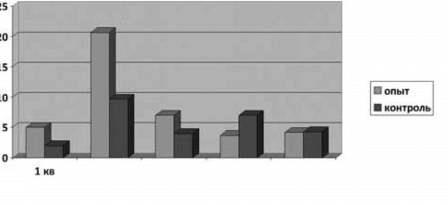
Рис. 1. Снижение гибели сеголеток радужной форели при проведении лечебно-профилактического кормления с пробиотиков Ветом 1.1 и с аскорбиновой кислотой.
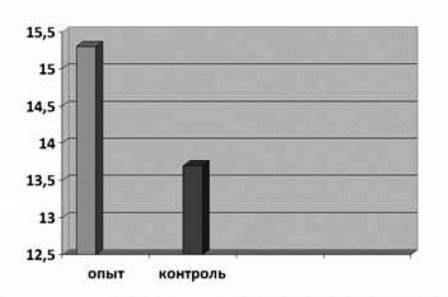
Рис. 2. Средняя масса тела сеголеток радужной форели в подопытной и контрольной группах.
ражение спинных плавников, не выявленное в контроле.
Тем не менее, к концу наблюдений отход рыб в подопытной группе снизился по сравнению с периодом максимальной гибели в 4,9 раз, а в контрольной группе - в 2,2 раза.
Если в начале опыта навеска сеголеток подопытной группы незначительно (на 0,66 г) превышала навеску в контрольной группе, то в конце опыта навеска в подопытной группе превышала навеску в контроле на 1,6 г.
Состояние жабр и внутренних органов у сеголеток нормализовалось как опыте, так и в контроле. Также наблюдали восстановление нормального состояния эритроцитов у рыб обеих групп. Это свидетельствует о до-статочной эффективности стандартной методики профилактики заболеваний при стрессовой ситуации. Однако надо отметить ее явную недостаточность при сильном поражении рыб, что выразилось в повышении отхода в контрольной группе при прекращении введения в корм аскорбиновой кислоты. В то же время рыбы контрольной группы продемонстрировали устойчивое улучшение эпизоотического и физиологического состояния.
Введение пробиотика Ветом 1.1 позво-лило в сравнительно короткий срок снизить гибель рыб при вспышке бактериального заболевания, развивавшегося на фоне токсикоза, нормализовать их физиологическое состояние и активизировать регенерационные процессы. Необходимо учитывать, что токсический процесс характеризуется обрати-мостью, т. е. организм рыб способен восстанавливать свои функции при прекращении или снижении интенсивности токсического воздействия [7]. В этот период также введение пробиотика Ветом 1.1 оказывает положительное воздействие на физиологическое состояние рыб и способствует скорейшему восстановлению организма.
Выводы
Проведенные нами исследования по оценке эффективности применения препарата Ветом 1.1 в УЗВ позволяют сделать ряд выводов.
1. Отмечено усиление регенерацион-ных процессов, активизация нормализации общего физиологического состояния, вос-становление нормального состояния клеток красной крови (эритроцитов). Это позволяет рекомендовать использование препарата Ве-том 1.1 для форели, выращиваемой в УЗВ, для улучшения их эпизоотического и физиологического состояния при обострении бактериальной инфекции, развивающейся на фоне токсического поражения.
2. Наблюдали увеличение навески у подопытных рыб, что свидетельствует о более интенсивном темпе роста рыб, в корм которых вводили Ветом 1.1.
3. Отмечена устойчивость рыб, прошедших курс лечебно-профилактического корм ления препаратом Ветом 1.1 к неблагоприятным условиям содержания.
4. Введение препарата Ветом 1.1 рекомендуется проводить курсом в течение 10 дней в профилактической дозировке 50 мг/кг корма с добавлением аскорбиновой кислоты (1,5 г/кг корма) либо в лечебной дозировке 75 мг/кг корма с добавлением аскорбиновой кислоты (1,5 г/кг корма).
В дальнейшем требуются дополнительные исследования по эффективности воздействия препарата Ветом 1.1. на эпизоотическое и физиологическое состояние рыб разных возрастных групп, содержащихся в УЗВ.
Список литературы
1. Быховская-Павловская, И. Е. Паразитологическое исследование рыб / М.-Л. : изд. АН СССР, 1952. -63 с.
2. Васюков, И. И. Изучение микрофлоры форели в замкнутых системах / И. И. Васюков, Е. В. Авдеева // Сборник научных трудов КТИ «Биологические осно-вы индустриальной аквакультуры». — Калининград, 1984.-С. 54-59.
3. Житенева, Л. Д. Экологические закономерности ихтиогематологии/Л. Д. Житенева. —Ростов-на-Дону. — 1999.-54 с.
4. Житенева, Л. Д. Основы ихтиогематологии (в сравнительном аспекте) / Л. Д. Житенева, Э. В. Макаров, О. А. Рудницкая. - Ростов-на-Дону, 2004.-311 с.
5. Евдокимова, Е. Б. Проблема болезней рыб при искусственном воспроизводстве рыб в некоторых хозяйствах Калининградской области / Е. Б. Евдокимова, Е. В. Авдеева, М. Ю. Котлярчук // Материалы докладов II Международного симпозиума «Ресурсосберегающие технологии в аквакультуре». — Краснодар, 1999.-С. 34.
6. Котлярчук, М. Ю. Зараженность карпа бактериями рода Aeromonas в установке с замкнутым циклом водообеспечения Калининградского морского рыбного порта и оценка их патогенности / М. Ю. Котлярчук // Сборник научных трудов КГТУ «Гидробиология на рубеже веков и тысячелетий». — Калининград, 2001.-С. 182-187.
7. Лукьяненко, В. И. Общая ихтиотоксикология / В. И. Лукьяненко. - М., 1983. - 319 с.
8. Репина, Н. Н. Опыт применения препаратов Ветом в промышленном рыбоводстве / Н. Н. Репина, Т. А. Нечаева, А. Д. Соколов // Материалы научной конференции «Садковое рыбоводство. Технология выращивания. Кормление рыб и сохранение их здоровья». - Петрозаводск, 2008. - С. 85-88.
9. Токсикозы рыб с основами патологии. Справочная книга / составители Н. М. Аршаница, М. А. Перевозников. - СПб., 2006. - 179 с.
10. Lumsden, J. S. Necrotic miositis in cage cultured rainbow trout (Oncorhynchus mykiss Walbaum), caused by Flexibacter psychrophilus / J. S. Lumsden, V. E. Ostland, H. W. Ferguson // J. Fish Diseases. - 1996, Vol. 19, №2.-P. 113-119.